![]()

Chapitre 6
IMMUNITE A MEDIATION CELLULAIRE
I – Introduction
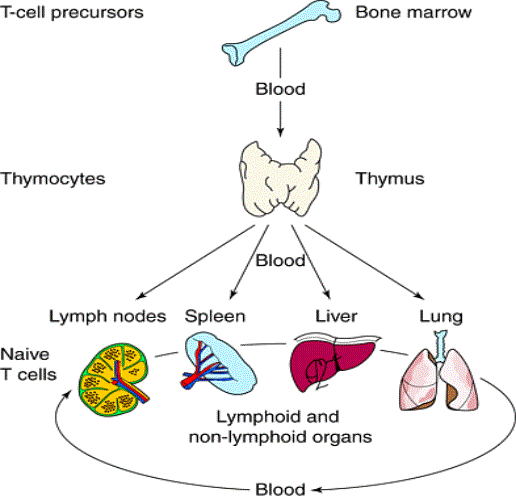
Après leur développement dans le thymus, les cellules T
entrent dans le pool des lymphocytes T périphériques. Ces cellules circulent entre
le sang et les organes lymphoïdes secondaires jusqu’à ce qu’elles rencontrent
l’antigène dont elles sont spécifiques. Pour participer à la réponse
immunitaire adaptative, ces lymphocytes T naïfs doivent proliférer et se
différencier en cellules capables de contribuer à l’élimination du pathogène.
La première rencontre entre l’antigène présenté à la surface d’une cellule
spécialisée et le lymphocyte T conduit à une réponse immunitaire primaire et
induit dans le même temps une mémoire immunitaire. Les cellules mémoires ainsi
générées permettront de protéger l’organisme contre une infection ultérieure du
même type. De nombreux critères distinguent les cellules effectrices de leurs
précurseurs naïfs.
Figure 1 : Recirculation des lymphocytes.
II – Etapes initiales de l’activation des lymphocytes T par
l’antigène
A
– Introduction
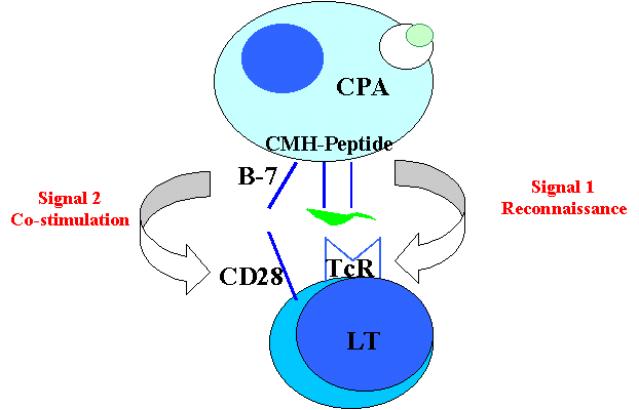
L’activation des cellules T naïves nécessite la
reconnaissance d’un fragment peptidique étranger fixé sur une molécule du CMH
autologue. Si cet événement de reconnaissance est nécessaire, il ne peut à lui
seul, permettre l’activation du lymphocyte T. L’activation du lymphocyte T
requiert la présence de signaux de co-stimulation délivrés à la cellule T par
les cellules présentatrices de l’antigène. Seules les cellules présentatrices
de l’antigène expriment à leur surface à la fois le complexe CMH-peptide et les
molécules de co-stimulation nécessaires à l’expansion clonale des lymphocytes T
naïfs et leur différenciation en cellules effectrices activées.
Figure 2 : Etapes initiales de l’activation des lymphocytes T.
B
– Interactions cellulaires dans les organes lymphoïdes secondaires.
La réponse immunitaire adaptative n’est pas amorcée au site d’entrée du pathogène dans l’organisme. Elle se développe dans les organes lymphoïdes périphériques dans lesquels le micro-organisme ou ses produits sont transportés via le réseau lymphatique. Les pathogènes qui pénètrent dans l’organisme par voie sanguine (ou au cours d’une septicémie) sont piégés dans la rate alors que ceux dont la porte d’entrée est cutanée ou muqueuse s’accumulent dans les ganglions ou les plaques de Peyer ou les amygdales. Tous ces organes lymphoïdes secondaires contiennent des cellules présentatrices de l’antigène spécialisées dans la capture des antigènes et l’activation des lymphocytes T. Certaines cellules comme les cellules de Langerhans (cellules dendritiques de la peau) sont capables de capter localement l’antigène et de le transporter dans les organes lymphoïdes secondaires.
Une cellule T naïve pénètre dans le ganglion en traversant
des vaisseaux spécialisés connus sous le nom de "high endothelial
venule" (HEV). Les lymphocytes T circulent de façon continue entre le sang
et les organes lymphoïdes secondaires favorisant ainsi le contact entre les
cellules T et les CPA du ganglion. Ce phénomène augmente considérablement la
probabilité de rencontre entre un complexe CMH-peptide et le lymphocyte T
porteur du récepteur spécifique; ce phénomène est crucial pour le déclenchement
d’une réponse immunitaire adaptative puisque qu’environ une cellule T sur un
million est spécifique d’un complexe CMH-peptide particulier. La réponse
immunitaire adaptative dépend de l’expansion et de la différenciation de ces
rares cellules T spécifiques. Les cellules T qui ne rencontrent pas leur
antigène dans le ganglion, migrent dans la région médullaire du ganglion où
après leur passage dans les vaisseaux lymphatiques efférents, elles regagnent la
circulation sanguine. Les cellules T naïves qui rencontrent l’antigène présent
à la surface d’une CPA arrêtent leur migration, prolifèrent et se différencient
en cellules effectrices activées.
Figure 3 : Interactions cellulaires dans les organes lymphoïdes
secondaires.
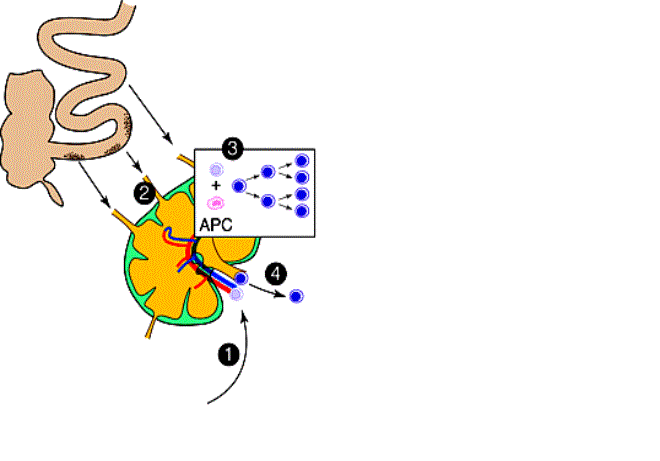
(1) les cellules T naïves entrent dans le ganglion par les high endothelial venules. (2) Les Antigènes gagnent le ganglion par les vaisseaux lymphatiques afférents. (3) Les cellules présentatrices d’antigènes des aires T des organes lymphoïdes, présentent des antigènes aux lymphocytes T naïfs qui s’activent et prolifèrent. (4) Les cellules T actives quittent le ganglion par les vaisseaux lymphatiques efférents et rejoignent la circulation.
Les trois principales CPA présentes dans les organes
lymphoïdes périphériques sont les cellules dendritiques, les macrophages et les
lymphocytes B. Chacune de ces cellules est spécialisée pour apprêter et
présenter l’antigène aux lymphocytes T spécifiques.
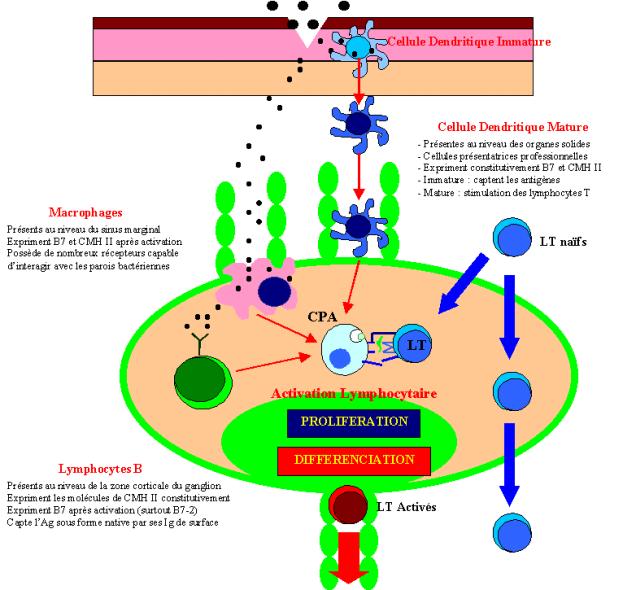
Figure 4 : Différents types de cellules présentatrices d’antigène.

Les cellules dendritiques fonctionnent exclusivement comme
CPA, alors que les macrophages et les lymphocytes B exercent aussi d’autres
fonctions au cours de la réponse immunitaire. Seuls ces trois types cellulaires
expriment les molécules de co-stimulation indispensables à l’activation des
cellules T naïves. Toutefois, les cellules dendritiques sont les seules à
exprimer constitutivement ces molécules qui ne seront induites sur les
macrophages et les cellules B qu’après leur contact avec le micro-organisme
pathogène. Ces trois types de CPA sont distribués de façon différente au sein
des organes lymphoïdes secondaires. Les cellules dendritiques sont présentes
principalement dans les zones T dépendantes du ganglion, les macrophages sont
présents dans toutes les zones du ganglion et les lymphocytes B sont retrouvés
dans les follicules primaires des organes lymphoïdes secondaires. La génération
de cellules effectrices prend quelques jours. A la fin de cette période, les
cellules effectrices activées quittent les organes lymphoïdes, repassent dans
le sang et migrent finalement au site de l’infection.
Figure 5 : Localisation et rôle des cellules présentatrices d’antigène.
C – Rôle des molécules d’adhésion
Au cours de leur migration à travers la zone corticale des
ganglions lymphatiques, les cellules T naïves se fixent de façon transitoire
sur chaque CPA qu’elle rencontre. Les CPA professionnelles peuvent interagir
efficacement avec les lymphocytes T naïfs par l’intermédiaire de molécules
d’adhérences. Ces molécules stabilisent la fixation des lymphocytes sur la CPA.
Cette fixation transitoire entre la cellule naïve et la CPA permet au
lymphocyte T d’avoir le temps nécessaire pour tester un grand nombre de
complexes CMH-peptides présents à la surface de la CPA. Dans les rares cas où
la cellule T reconnaît un complexe CMH-peptide, les signaux induits par le TcR
conduisent à des modifications conformationnelles des molécules d’adhésion
ayant pour effet d’augmenter l’affinité de l’interaction entre les deux types
cellulaires. Cette association peut persister pendant plusieurs jours pendant
lesquels la cellule T naïve prolifère et se différencie en cellule effectrice
activée.
Figure 6 : Rôle des molécules d’adhésion.
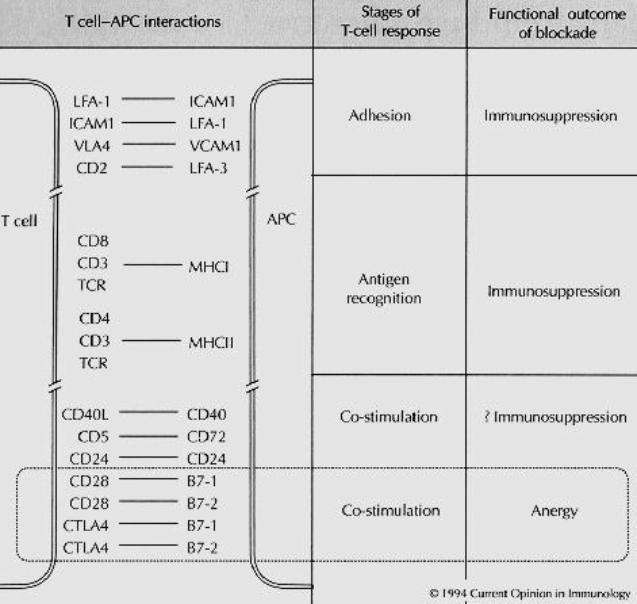
D – Rôle des
molécules de co-stimulation dans l’induction d’une réponse immune T-dépendante
Les cellules T sont activées lorsque le complexe TcR/co-récepteur CD4 ou CD8 reconnaît un complexe CMH-peptide à la surface d’une CPA. Toutefois, cette interaction ne peut à elle seule stimuler la prolifération des cellules T naïves et leur différenciation en cellules effectrices. L’expansion clonale des cellules T spécifiques de l’antigène nécessite un deuxième signal qui doit être délivré à la cellule T par la même cellule que celle qui présente l’antigène. Les lymphocytes T CD8+ semblent requérir un signal de co-stimulation plus fort que les lymphocytes T CD4+. L’expansion clonale des lymphocytes T CD8+ dépend d’ailleurs en grande partie de la coopération cellulaire des lymphocytes T CD4+ interagissant avec la même CPA.
Les molécules de co-stimulation les mieux caractérisées
sont les molécules B-7 (B7-1 ou CD80 et B7-2 ou CD86). Ces molécules ont une
structure homodimérique. Elles appartiennent à la superfamille des
immunoglobulines. B7-1 et B7-2 sont exprimés exclusivement à la surface de
cellules capables de stimuler la prolifération des lymphocytes T. Les molécules
B7 interagissent avec deux types de récepteurs présents à la surface des
lymphocytes T : CD28 et CTLA-4. La ligation B7/CD28 stimule la
prolifération des cellules T. CD28 est le seul récepteur des molécules de
co-stimulation exprimé sur les cellules T naïves. Après leur activation, les
cellules T peuvent exprimer le second récepteur des molécules B7 c’est à dire
CTLA-4. CTLA-4 a une forte homologie de séquence avec CD28 et les deux
molécules sont codées par des gènes voisins sur le génome. CTLA-4 se fixe sur
les molécules B7 avec une affinité vingt fois supérieure à celle de CD28 et
induit un signal inhibiteur aux lymphocytes T activés. De ce fait, CTLA-4 joue
un rôle primordial dans le contrôle de la réponse immunitaire en limitant une
expansion trop importante des lymphocytes T activés par l’antigène et en
permettant l’arrêt de la réponse immunitaire. Ce rôle de CTLA-4 a été confirmé
chez des souris invalidées pour ce gène. Ces souris présentent en effet un
syndrome lymphoprolifératif massif fatal. Bien que de nombreuses molécules
aient été impliquées dans les phénomènes de co-stimulation, jusqu’à présent,
seuls B7-1 et B7-2 sont capables lors de leur interaction avec CD28 de produire
les signaux nécessaires à l’induction d’une réponse immunitaire normale.
Figure 6 : Rôle des molécules de co-stimulation dans l’activation
lymphocytaire.
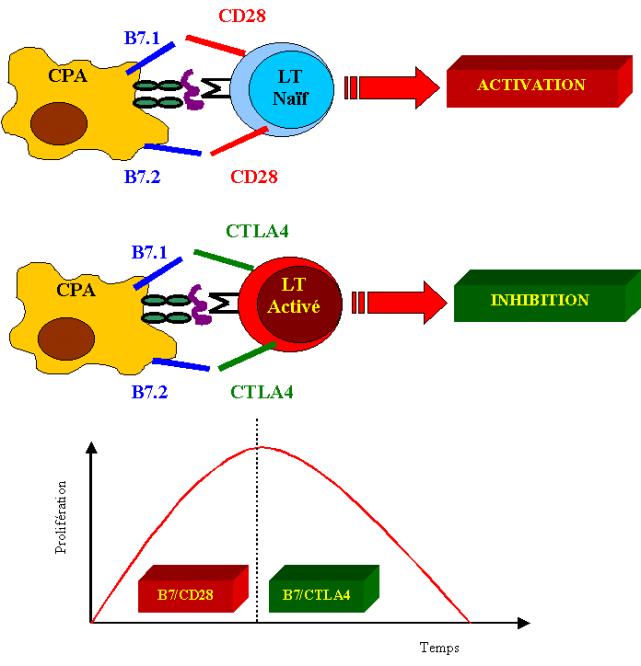
E
–Déclenchement de la réponse immunitaire par les CPA
E
–1 – Rôle des cellules dendritiques
La seule fonction connue des cellules dendritiques est la
présentation de l’antigène aux lymphocytes T. Les cellules dendritiques matures
sont les cellules les plus aptes à stimuler des cellules T naïves. Cette
aptitude n’est pas partagée par les cellules dendritiques immatures retrouvées
dans la plupart des épithéliums et au sein des organes solides comme le cœur et
les reins. Les cellules dendritiques proviennent de progéniteurs médullaires.
Les cellules ainsi produites migrent dans la circulation et gagnent les sites
périphériques. A ce niveau, elles ont un phénotype immature qui se caractérise
par une faible expression des molécules de classe II du CMH et par l’absence de
molécule de co-stimulation à leur surface. Les cellules dendritiques immatures
sont donc incapables d’activer les cellules T naïves. En revanche, elles sont
particulièrement efficaces pour capter les antigènes par endocytose grâce à des
récepteurs spécifiques comme DEC 205, ou par macropinocytose. Les cellules
dendritiques immatures persistent dans les tissus pendant de longues périodes.
Les cellules dendritiques immatures typiques sont les cellules de Langerhans de
la peau. Elles sont activées pendant l’infection et migrent alors par les
vaisseaux lymphatiques vers le ganglion loco-régional. A ce niveau, le
phénotype des cellules dendritiques se modifie. Les cellules dendritiques
matures perdent leur capacité d’endocytose et de pinocytose mais expriment à
présent des niveaux élevés de molécules du CMH, de molécules d’adhésion et de
molécules de co-stimulation. Les cellules dendritiques matures sécrètent en
outre de grandes quantités de chimiokine DC-CK1 qui attirent spécifiquement les
lymphocytes T naïfs. Toutes ces propriétés expliquent l’efficacité des cellules
dendritiques matures pour stimuler les lymphocytes T naïfs. Parmi les antigènes
susceptibles d’être présentés par les cellules dendritiques on retrouve des
protéines de l’environnement, des virus des bactéries et éventuellement des
allo-antigènes provenant d’un organe transplanté.
Figure 7 : Rôle des cellules dendritiques.
E
– 2 – Rôle des macrophages
La plupart des pathogènes qui entrent dans l’organisme sont rapidement phagocytés et éliminés par les phagocytes. Ces cellules sont en première ligne au cours de l’infection. Elles détruisent les micro-organismes sans notion de spécificité participant ainsi à l’immunité innée non adaptative. Les micro-organismes qui sont détruits par les phagocytes sans l’aide des cellules T ne causent aucune maladie ni ne nécessitent de réponse immunitaire adaptative. Les pathogènes ont, de leur coté, développé des mécanismes pour tenter d’éviter leur élimination par les effecteurs de la réponse innée. Dans ce cas, l’élimination du pathogène requiert l’induction d’une réponse immunitaire adaptative. Les macrophages dans lesquels persistent les micro-organismes pathogènes contribuent à la réponse immunitaire adaptative en présentant des peptides antigéniques du pathogène aux lymphocytes T spécifiques qui vont alors s’activer et produire des facteurs capables d’augmenter les propriétés de phagocytose et de bactéricidie du macrophage.
Les CPA présentent des fragments peptidiques de l’antigène fixés sur des molécules du CMH et activent les cellules T naïves grâce aux molécules de co-stimulation. Les macrophages au repos n’expriment ni B7 ni les molécules de classe II du CMH. L’expression de ces molécules est induite après l’ingestion du micro-organisme. Les macrophages possèdent des récepteurs capables de se fixer sur les constituants bactériens (ex : récepteur du mannose). Une fois fixé sur le macrophage, le micro-organisme est phagocyté et dégradé dans les endosomes et les lysosomes, générant ainsi des peptides antigèniques qui peuvent être présentés par les molécules de classe II du CMH. De façon concomitante, les molécules de classe II et B7 s’expriment à la surface de la cellule macrophagique. L’induction des molécules de co-stimulation par des constituants spécifiques du micro-organisme (ex : LPS bactérien) permet au système immunitaire de distinguer les antigènes infectieux des protéines inoffensives. En effet, de nombreuses protéines étrangères à l’organisme n’induisent pas de réponse immunitaire, probablement parce qu’elles ne peuvent induire l’expression des molécules de co-stimulation sur les cellules présentatrices de l’antigène. Cependant, lorsque ces mêmes protéines sont mélangées avec des bactéries, elles deviennent immunogènes. Dans ce cas, les bactéries servent d’adjuvant à la protéine injectée.
Les macrophages éliminent en permanence des cellules mortes ou sénescentes. Les cellules de Kupfer du foie et les macrophages de la rate purgent ainsi l’organisme de milliers de cellules par jour. Il est donc particulièrement important que les macrophages n’induisent pas au cours de ce processus, de réponse immunitaire contre des protéines du soi présentes au sein des cellules phagocytées. Plusieurs mécanismes permettent d’éviter qu’un tel phénomène ne déclenche une réaction auto-immune. D’une part, peu de cellules T naïves passent au contact des cellules de Küpfer, d’autre part, l’ingestion de cellules apoptotiques par le macrophage induit la synthèse d’interleukine-10 qui diminue fortement l’expression des molécules de classe II sur les macrophages eux-mêmes. Ainsi, bien que ce processus génère la présence de nombreux peptides du soi dans les endosomes des macrophages, une réponse auto-immune ne peut généralement pas être induite par ce mécanisme.
E
– 3 – Rôle des lymphocytes B.
Les lymphocytes B captent les molécules solubles par leurs immunoglobulines de surface. L’antigène est capté sous forme native sans nécessiter de dégradation préalable en fragments peptidiques. Le complexe Ig/antigène est alors endocyté puis dégradé en fragments peptidiques dans les endosomes qui sont présentés ensuite par les molécules de classe II du CMH. Les lymphocytes B expriment fortement les molécules de classe II du CMH ce qui explique le nombre important de complexe CMH-peptide retrouvé à la surface de la cellule. Les lymphocytes B n’expriment pas de manière constitutive les molécules de co-stimulation B7. Ces dernières peuvent être induites par de nombreux constituants bactériens. Les cellules B expriment les deux types de molécule B7 mais surtout B7-2. L’expression inductible de B7 explique qu’il sera nécessaire de co-injecter des adjuvants bactériens si on veut immuniser efficacement un animal contre des protéines solubles. Sans ces adjuvants, la cellule B présente des peptides antigèniques sans molécules de co-stimulation nécessaire à l’activation des cellules T. L’anergie des lymphocytes T qui résulte de cette présentation induit un état de non-réponse vis à vis de l’antigène injecté.
III – Prolifération et différenciation
des cellules T activées.
A
– Rôle de l’interleukine-2.
Les cellules T naïves peuvent vivre des années sans se diviser. Ces petites cellules au repos ont une chromatine dense, un cytoplasme peu abondant et une faible synthèse protéique. Après leur activation, ces cellules doivent entrer en cycle et se diviser rapidement pour donner naissance à de nombreuses cellules filles qui se différencieront en cellules effectrices activées. La prolifération et la différenciation sont induites par un facteur de croissance protéique (une cytokine) appelé interleukine-2 et produit par le lymphocyte T activé lui-même. Au cours de son activation, le lymphocyte T exprime rapidement à sa surface le récepteur de l’interleukine-2 (IL-2).
Ce récepteur est composé de 3 chaînes a, b et g. Au repos, seules les chaînes b et g sont exprimées. Le récepteur ainsi formé a une très faible affinité pour l’IL-2. Au cours de l’activation du lymphocyte T, la chaîne a est synthétisée et elle s’associe au récepteur gb augmentant ainsi considérablement l’affinité du récepteur pour l’IL-2. La fixation de l’IL-2 sur son récepteur induit la prolifération du lymphocyte T.
La production d’IL-2 est le principal effecteur de la prolifération et de la différenciation des lymphocytes T en cellules effectrices. Le rôle majeur des molécules de co-stimulation est d’induire la synthèse d’IL-2.
La reconnaissance du complexe
CMH-peptide par le TcR induit une cascade d’événements intracellulaires
aboutissant à la translocation nucléaire du facteur de transcription NF-AT. Ce
dernier se fixe sur des régions promotrices du gène de l’IL-2 et induit sa
transcription. Cependant, cette seule interaction est insuffisante pour que la
protéine IL-2 soit produite. En effet, les ARN messagers de l’IL-2 possèdent
dans leur région 3’ non traduite une zone d’instabilité qui diminue très
fortement la demi-vie des transcrits de l’IL-2. Cette région d’instabilité est
en outre un facteur primordial dans le contrôle de la production de cette
cytokine. L’interaction des molécules de co-stimulation B7 avec CD28 exprimé
sur les lymphocytes T permet de stabiliser les transcrits pour l’IL-2. Ce
phénomène permet d’augmenter trente fois la traduction de l’IL-2 d’un facteur
30. De plus, CD28 active en parallèle d’autres facteurs de transcription comme
NF-kB et AP-1 qui augmentent encore la transcription du gène de l’IL-2. Au
final, l’interaction B7/CD28 multiplie par 100 la quantité d’IL-2 produite par
les lymphocytes T.
Le rôle central de l’IL-2 dans
la réponse immunitaire adaptative est en outre illustré par les médicaments
utilisées pour bloquer la réponse immunitaire comme le rejet de greffe. La
cyclosporine et le FK506 inhibent la production d’IL-2 en bloquant les voies de
transduction du signal médiées par le TcR. La Rapamycine inhibe quant à elle
les signaux produits par le récepteur de l’IL-2.
Lorsqu’une cellule T reconnaît un antigène en l’absence des co-signaux de stimulation, très peu d’IL-2 est produit et la cellule naïve ne prolifère pas. Dans ce cas, la cellule naïve entre dans un état de paralysie fonctionnelle appelée anergie. La caractéristique principale d’une cellule anergique est son incapacité de produire de l’IL-2. Cet état empêche la prolifération et la différenciation des cellules naïves en cellules effectrices même si l’antigène est présenté aux lymphocytes T anergiques par une CPA contenant à la fois le complexe CMH-peptide approprié et les molécules de co-stimulation. Ce phénomène permet en outre d’assurer la tolérance des cellules T aux antigènes du soi.
Lorsque l’antigène et des molécules de co-stimulation
interviennent, l’IL-2 produite favorise l’expansion clonale des cellules
naïves. Après 4 à 5 jours d’intense prolifération, ces lymphocytes T se
différencient en cellules T effectrices capables de synthétiser toutes les
protéines nécessaires à leur fonction de cellule T cytotoxique ou auxiliaire.
Les cellules effectrices subissent des changements qui les distinguent des
cellules naïves. Ainsi, une cellule effectrice ne requiert plus la présence de
molécule de co-stimulation pour exercer son effet sur sa cellule cible :
ainsi, les lymphocytes T CD8+ activés peuvent détruire n’importe quelle cellule
infectée par un virus qu’elle exprime ou non des molécules de co-stimulation.
Parmi les autres modifications qui distinguent les cellules naïves des cellules
activées, on notera l’expression différentielle de certaines molécules
d’adhérence. Les cellules effectrices n’expriment plus la L-sélectine ce qui
empêche leur circulation à l’intérieur du ganglion mais expriment VLA-4 qui
favorise la fixation des cellules activées au niveau de l’endothélium
vasculaire des sites infectés.
Figure 8 : Rôle de l’interleukine-2 dans l’activation lymphocytaire.
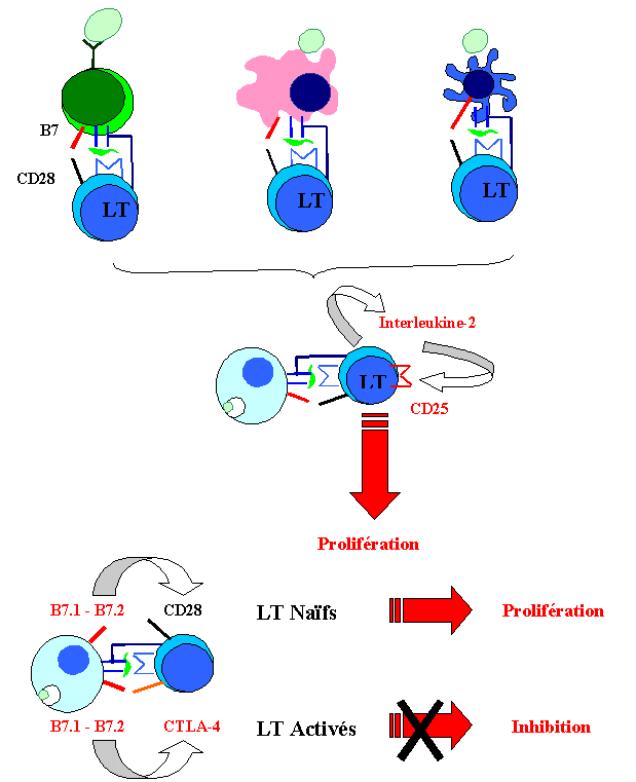
B
– Différenciation des lymphocytes T CD4+
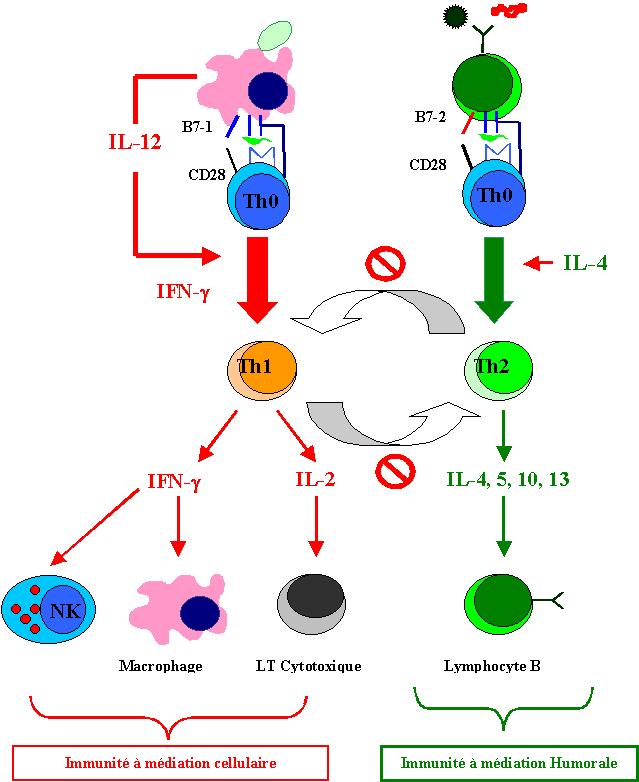
Les cellules T CD8+ qui sortent du thymus sont déjà programmées pour devenir des effecteurs cytotoxiques. Le cas des cellules CD4+ est plus complexe. Les lymphocytes T CD4+ naïfs peuvent en effet se différencier après leur activation en lymphocytes Th1 ou en lymphocytes Th2. Ces deux types de cellules CD4+ diffèrent par le spectre des cytokines qu’elles peuvent produire. Ces deux populations possèdent donc des fonctions effectrices différentes.
La différenciation en l’un ou l’autre type de cellule CD4+ se fait lors du premier contact avec l’antigène. Les facteurs qui déterminent si une cellule CD4+ va se différencier en Th1 ou Th2 sont incomplètement connus. Le type de cytokines initialement induites par l’agent infectieux (IL-4 ou IL-12), le type de molécule de co-stimulation engagé lors du premier contact avec l’antigène, le type de cellule présentatrice et la nature du complexe CMH-peptide peuvent jouer un rôle dans la différenciation.
La différenciation en lymphocyte Th1 ou Th2 ayant lieu au tout début de la réponse immunitaire, les cytokines produites par les cellules de l’immunité innée sont fondamentales dans le type de réponse adaptative induite. En effet, si les cellules de l’immunité innée produisent de l’IL-12, la différenciation se fera dans le sens Th1 et la réponse immunitaire adaptative qui se développera sera une réponse à médiation cellulaire. Si au contraire, les cellules de l’immunité innée produisent de l’IL-4, la différenciation se fera dans le sens Th2 et la réponse immunitaire sera à médiation humorale.
L’infection par Mycobacterium
leprae (bacille de la lèpre) montre bien les conséquences que peuvent avoir une
telle dichotomie sur le pronostic d’une infection. M. leprae est une bactérie
intracellulaire qui infecte les macrophages. Une réponse immunitaire appropriée
vis à vis de ce pathogène nécessite l’activation des macrophages par les
lymphocytes Th1. Chez les patients qui développe ce type de réponse (lèpre
tuberculoïde) la charge bactérienne est réduite, peu d’anticorps sont produits
et bien que les lésions inflammatoires de la peau et des nerfs périphériques
soient induites par l’activation macrophagique, la maladie progresse lentement.
En revanche, chez les patients qui développent une réponse de type Th2, la
réponse antibactérienne est à médiation humorale. Les anticorps produits ne
peuvent atteindre la bactérie intracellulaire qui se multiplie alors
abondamment dans les macrophages causant des dommages tissulaires majeurs
responsables le plus souvent du décès du patient.
Figure 9 :
Dichotomie Th1/Th2.
C –
Différenciation des lymphocytes T CD8+.
Les
cellules T CD8+ naïves se différencient en effecteurs cytotoxiques.
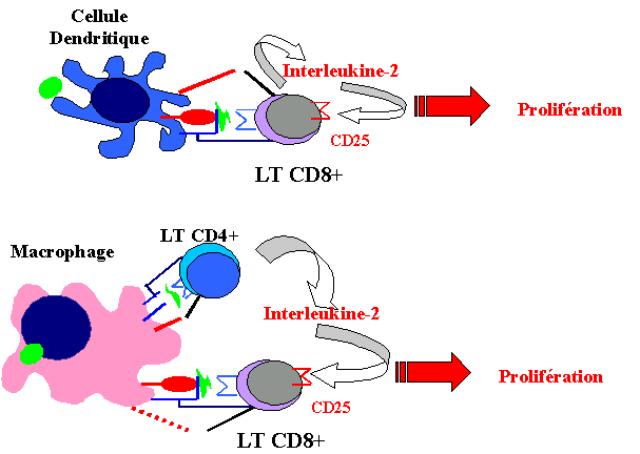
L’activation des lymphocytes T CD8+ naïfs nécessite des co-signaux d’activation
plus intenses que les les cellules T CD4+. Les cellules T CD8+ peuvent être
activées par les cellules dendritiques qui possèdent un pouvoir de
co-stimulation élevé. Les cellules dendritiques peuvent induire directement la
synthèse d’IL-2 par les cellules T CD8+ et ainsi leur prolifération et leur
différenciation. La réponse T cytotoxique vis à vis de certains virus ou au
cours du rejet de greffe nécessite cependant la présence des lymphocytes T
CD4+. Dans ce cas, les deux types cellulaires doivent reconnaître des complexes
CMH-peptides présents à la surface de la même CPA. Les lymphocytes T CD4+
compensent dans ce cas le faible pouvoir de co-stimulation de certaines CPA.
Cette coopération cellulaire peut revêtir deux aspects. Si le lymphocyte T CD4+
est une cellule effectrice, elle peut activer la CPA et favoriser l’expression
des molécules de co-stimulation. Si la cellule T CD4+ est une cellule naïve
elle s’active au contact du complexe CMH-peptide et libère de l’IL-2 qui pourra
agir de manière paracrine sur la cellule T CD8+ voisine.
Figure 10 : Différenciation des lymphocytes T CD8+.
IV – Propriétés générales des cellules
effectrices.
A
– Introduction
Les fonctions effectrices de toutes les cellules T impliquent l’interaction avec une cellule cible exprimant à sa surface le complexe CMH-peptide approprié. Les molécules effectrices libérées par les cellules T activées sont dirigées spécifiquement sur la cellule cible par des mécanismes activés par la reconnaissance de l’antigène présent à la surface de la cellule cible. Le mécanisme de ciblage de la cellule T sur sa cible est commun à tous les types de cellules effectrices alors que leur fonction effectrice dépend des protéines de membrane qu’elles expriment ou des protéines solubles qu’elles sécrètent après la fixation de leur TcR sur les complexes CMH-peptides présents sur la cellule cible.
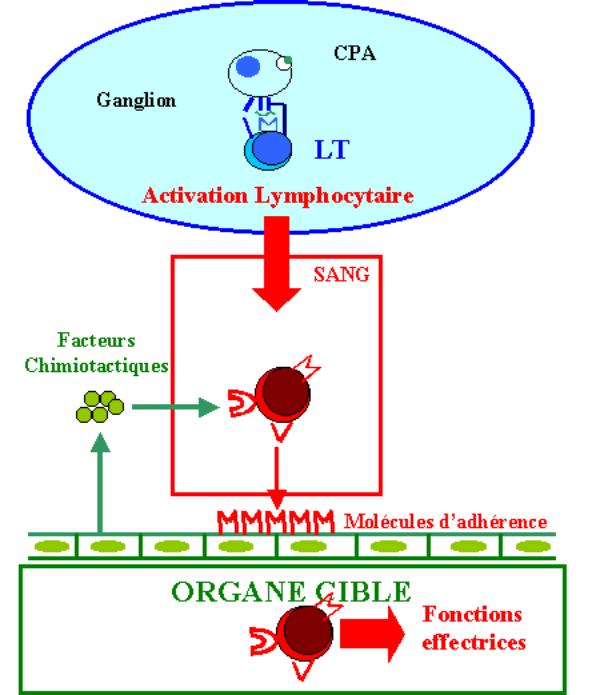
B
– Interaction entre la cellule effectrice et sa cible
Lorsqu’une cellule T effectrice a terminé sa différenciation dans les organes lymphoïdes secondaires, elle doit trouver la cellule cible qui exprime le complexe CMH-peptide reconnu spécifiquement par son TcR. Ce processus se déroule en deux étapes. Premièrement, la cellule T effectrice activée doit quitter les organes lymphoïdes pour gagner la circulation sanguine ou lymphatique. Deuxièmement, grâce aux molécules exprimées à sa surface, la cellule activée doit migrer dans les tissus périphériques où siège l’infection. Les cellules T activées sont guidées vers leur site d’action par des modifications locales des cellules endothéliales qui expriment au niveau du site inflammatoire des molécules d’adhésion et par des facteurs chimiotactiques solubles.
La fixation initiale de la cellule T sur sa cible est un
processus indépendant de l’antigène et implique des molécules d’adhésion comme
LFA-1 et CD2. Le niveau d’expression de ces molécules est très élevé sur les
cellules activées ; elles peuvent donc, contrairement aux cellules naïves,
se fixer efficacement sur des cellules qui expriment de faibles quantités
d’ICAM-1 et de LFA-3. Cette interaction est normalement transitoire. La
reconnaissance concomitante d’un complexe CMH-peptide à la surface de la
cellule cible augmente l’affinité des interactions médiées par les molécules
d’adhésion. Ce phénomène permet à la cellule effectrice de rester attachée à sa
cible le temps suffisant pour qu’elle puisse relarguer ses molécules
effectrices. Les cellules T CD4+ effectrices qui activent les macrophages et
favorisent la synthèse d’anticorps par les lymphocytes B doivent rester
longtemps en contact avec leur cible. Les cellules T cytotoxiques au contraire
s’attachent et se dissocient rapidement de leur cible.
Figure 11 : Interaction entre le lymphocyte T et sa cible.
C
– Libération des molécules effectrices
La fixation du TcR sur un complexe CMH-peptide n’induit
pas seulement l’augmentation de l’affinité de l’interaction entre la cellule
effectrice et sa cible : il induit aussi la polarisation de la cellule T.
Cette polarisation permet à la cellule effectrice de libérer ses molécules
effectrices directement au contact de la cellule cible. En effet, lorsque le
TcR reconnaît un complexe CMH-peptide cible, il s’agrège à la surface de la
cellule. Ce phénomène induit des modifications du cyto-squelette qui favorisent
la libération des molécules effectrices au point de contact entre la cellule
effectrice et la cellule cible. La polarisation de la cellule favorise aussi la
synthèse de novo de certaines protéines effectrices. Ainsi, l’IL-4, principale
cytokine produite par les lymphocytes Th2 est sécrétée dans le
micro-environnement constitué par l’interaction des membranes des cellules
cibles et effectrices. Bien que les quantités d’IL-4 produites soient faibles,
modestes, ce mécanisme permet d’obtenir de très forte concentrations d’IL-4
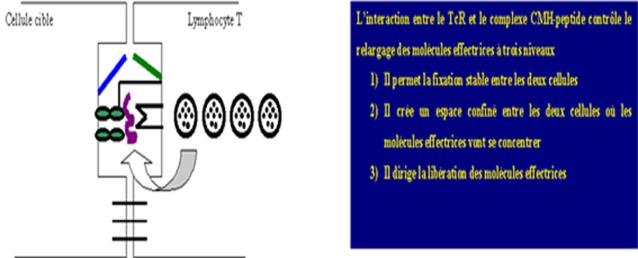
juste au contact de la cellule cible. Finalement, le TcR contrôle le relargage
des molécules effectrices à trois niveaux : il permet la fixation stable
entre les deux cellules, il crée un espace confiné entre les deux cellules où
les molécules effectrices seront concentrées et enfin, il dirige le relargage
des protéines effectrices juste au contact de la cellule cible. Tous ces
mécanismes contribuent à l’action sélective des molécules effectrices sur la
cellule exprimant le complexe CMH-peptide spécifique. De ce fait, l’activité
des cellules T est fortement spécifique de la cellule portant l’antigène même
si les molécules effectrices ne sont pas spécifiques de l’antigène.
Figure 12 : Libération de molécules effectrices.
D
– Cytokines produites par les lymphocytes T activés
Les molécules effectrices produites par les lymphocytes T activés appartiennent à deux grandes catégories : les cytotoxines et les cytokines.
Les cytotoxines sont stockées dans des granules spécialisés et sont libérées par les lymphocytes T CD8+ cytotoxiques. Leur libération doit être finement régulée car ces molécules ne sont pas spécifiques : elles peuvent pénétrer dans la bicouche lipidique et induire la mort de n’importe quelle cellule cible.
Les cytokines et les molécules membranaires apparentées sont synthétisées de novo par toutes les cellules T effectrices. Ces protéines agissent en se fixant sur des récepteurs spécifiques sur la cellule cible. Les cytokines sont les principaux médiateurs produits par les cellules T CD4+. De ce fait, les lymphocytes T CD4+ agissent sur des cellules cibles qui expriment les récepteurs spécifiques des cytokines qu’ils sécrètent. Outre les lymphocytes T, de nombreuses cellules immuno-compétentes ou non peuvent sécréter des cytokines. Les cytokines produites par les lymphocytes T sont communément appelées lymphokines les phagocytes mononucléés produisent de cytokines appelées monokines.
La principale cytokine produite par les lymphocytes T CD8+ est l’IFN-g. Cette cytokine bloque la réplication virale et conduit à l’élimination des virus des cellules infectées sans pour autant les détruire. Les lymphocytes T CD4+ de type Th1 produisent de l’IFN-g qui est la principale cytokine responsable de l’activation macrophagique induite par les cellules CD4+, et du TNF a et b qui active le macrophage, inhibe la réponse humorale et favorise le potentiel cytotoxique de certaines cellules. Les lymphocytes T CD4+ de type Th2 produisent de l’IL-4 et de l’IL-5 qui activent les cellules B et de l’IL-10 qui inhibe l’activation macrophagique. Les cellules Th1 et Th2 dérivent des cellules Th0 qui peuvent aussi produire dans une certaine mesure des cytokines comme l’IL-2, l’IL-4 et l’IFN-g.
La plupart des cytokines ont des actions locales agissant en synergie avec les molécules membranaires effectrices. Les effets des cytokines sont confinés à la cellule cible par un contrôle précis de leur synthèse. Ainsi, la synthèse d’IL-2, d’IL-4 et d’IFN-g dure aussi longtemps que l’interaction avec la cellule cible. En revanche, certaines cytokines peuvent agir à plus grande distance. Ainsi, l’IL-3 et le GM-CSF, libérés par les deux types de cellules auxiliaires, agissent sur la moelle osseuse. Ces cytokines augmentent la production médullaire de macrophages, de granuleux et de cellules dendritiques qui contribuent à la réponse immunitaire adaptative ou innée.
Les cytokines peuvent être regroupées en trois familles structurales : les hématopoïétines et interféron, les chimiokines, et les membres de la famille du TNF.
Les cytokines agissent sur des récepteurs qui peuvent aussi être groupés en familles sur la base de leurs différences structurales. Ces familles de cytokines et de récepteurs sont caractérisées par des fonctions communes et une localisation voisine sur le génome. Par exemple, parmi les hématopoïétines, l’IL-3, 4, 5, 13 et le GM-CSF ont des structures voisines, leurs gènes sont proches dans le génome et toutes ces cytokines sont produites par les lymphocytes Th2. De plus, elles se fixent sur des récepteurs de structures voisines puisque chacun des récepteurs partage la même chaîne b. Un autre groupe de récepteurs des hématopoïétines est défini par l’utilisation de la chaîne g du récepteur de l’IL-2. Cette chaîne est en effet retrouvée dans les récepteurs de l’IL2, 7, 9 et 15.
Les membres de la famille du TNF sont pour la plupart des protéines membranaires agissant sous forme trimérique et ont donc des propriétés légèrement distinctes de celles des autres cytokines. Toutefois, elles partagent de nombreuses propriétés avec les cytokines solubles produites par les lymphocytes T comme d’être synthétisées de novo après contact avec l’antigène et d’affecter le devenir de la cellule cible. Le TNF-a est une molécule synthétisée par les lymphocytes T sous forme homotrimérique soluble ou associée à la membrane. Le TNF-b peut aussi être sécrété mais cette cytokine semble être le plus souvent retrouvée associée à la membrane. Les récepteurs de ces molécules : TNF-R1 et TNF-R2 forment des homotrimères lorsqu’ils se fixent sur leurs ligands spécifiques. La structure trimérique est caractéristique des membres de la famille du TNF et ce phénomène semble être une étape fondamentale dans le déclenchement des voies de signalisation induite par ces récepteurs. La plupart des cellules T effectrices expriment à leur surface des cytokines de la famille du TNF : TNFa et b (protéines solubles), FasL et CD40L (protéines membranaires). Toutes ces molécules se fixent sur des membres de la famille des récepteurs du TNF : TNF-R1 et -R2, Fas et CD40.
Fas est exprimé sur de nombreuses cellules et notamment à la surface des lymphocytes activés. L’interaction de Fas avec son ligand naturel FasL induit la trimérisation du récepteur Fas. Il s’ensuit la fixation de molécules adaptatrice sur les death domains intracellulaires du récepteur Fas. Ces protéines adaptatrices sont alors susceptibles par l’intermédiaire de leur death effector domains d’activer des cystéines protéases : les caspases. Le clivage successif des caspases aboutit à l’activation d’une endonucléase endogène CAD qui induit un clivage inter-nucléosomal de la chromatine. Fas et FasL jouent un rôle important dans le contrôle de la réponse immunitaire. La mutation des gènes codant l’une ou l’autre de ces protéines conduit à un syndrome lympho-prolifératif majeur et à des phénomènes autoimmuns chez l’homme et la souris.
La région intracytoplasmique de CD40 ne possède pas de death domains. CD40 est impliqué dans l’activation des macrophages et des lymphocytes B. La ligation de CD40 sur la cellule B induit la prolifération et la commutation de classe des Ig. Sur les macrophages, CD40 induit la production de TNF et diminue le seuil d’activation des macrophages par l’IFN-g.
V – Cytotoxicité à médiation cellulaire
A
– Introduction
Tous les virus et de nombreuses bactéries se multiplient dans le cytoplasme des cellules infectées. A l’intérieur des cellules, ces pathogènes ne sont plus accessibles aux anticorps et ne peuvent être éliminés que par la destruction des cellules infectées. Cette fonction est assurée par les lymphocytes T CD8+ cytotoxiques. L’élimination des cellules infectées sans destruction des tissus sains voisins nécessite que les mécanismes de cytotoxicité soient à la fois efficaces et spécifiques de la cellule cible.
B
– Voies de lyse des cellules cibles.
Une cellule peut mourir de deux façons. Une agression physico-chimique comme, par exemple, la privation d’oxygène au cours de l’infarctus du myocarde ou des altérations membranaires induites par le complément conduisent à la désintégration cellulaire ou nécrose. La nécrose cellulaire commence toujours par des lésions membranaires. Les cellules et les tissus nécrotiques sont dégradés par les cellules phagocytaires. L’autre forme de mort cellulaire est appelée mort cellulaire programmée ou apoptose. L’apoptose est un phénomène physiologique normal intervenant dans les processus de remodelage tissulaires observés au cours du développement embryonnaire. De plus, au cours de la sélection thymique, les thymocytes non sélectionnés positivement ou sélectionnés négativement meurent par apoptose. L’apoptose se caractérise par des changements de la morphologie de la cellule. La cellule se suicide de l’intérieur : le cytoplasme se condense et bulle à l’extérieur de la cellule libérant des corps apoptotiques, la chromatine se fragmente et apparaît à bord lisse sous la membrane nucléaire. La caractéristique principale de ce type de mort cellulaire est la fragmentation internucléosomale de l’ADN, la membrane cellulaire restant intacte.
Les cellules T cytotoxiques détruisent leurs cibles en induisant leur apoptose. Ce phénomène est très rapide puisque si l’on met en contact des cellules T cytotoxiques et leurs cibles, la mort cellulaire programmée est induite dans les 5 minutes. La courte période nécessaire à la cellule cytotoxique pour induire l’apoptose de sa cible nécessite la libération de molécules activant les mécanismes intracellulaires d’apoptose dans la cellule cible. Parallèlement à la destruction de la cellule, les mécanismes apoptotiques peuvent aussi agir directement sur les micro-organismes cytosoliques. Par exemple, la nucléase qui clive l’ADN cellulaire peut aussi dégrader l’ADN viral. En outre, d’autres enzymes activées au cours du processus apoptotique peuvent aussi détruire certains pathogènes.
C
– Molécules solubles induisant l’apoptose des cellules cibles
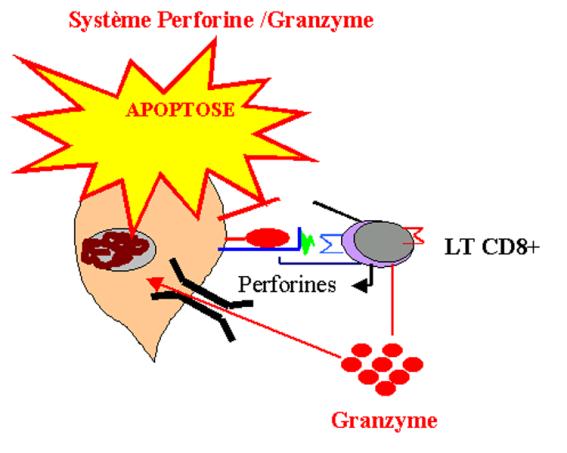
Le principal mécanisme par lequel la cellule T cytotoxique
exerce son effet est la libération dépendante du calcium de granules lytiques
spécialisés. Ces granules sont des lysosomes modifiés qui contiennent au moins
deux classes distinctes d’effecteurs cytotoxiques exprimés seulement dans les
lymphocytes T CD8+. Ces molécules sont stockées sous forme active dans des granules
lytiques. La première de ces molécules est la perforine. Cette protéine qui
possède une parenté structurale avec le complexe d’attaque membranaire se
polymérise pour former des pores dans la membrane de la cellule cible. La
seconde classe de protéines cytotoxiques comprend au moins trois sérines
protéases appelées granzymes. Les granzymes pénètrent dans la cellule cible par
les pores membranaires formés par les perforines. Bien que les granzymes jouent
un rôle dans l’induction de l’apoptose des cellules cibles, ces enzymes sont
incapables de fragmenter directement l’ADN nucléaire. En fait, ces enzymes
active la caspase 3 qui peut ensuite activer l’endonucléase CAD (caspase
activated desoxyribonucléase). CAD est l’effecteur final de la dégradation
de l’ADN au cours de l’apoptose. Les cellules apoptotiques sont rapidement
ingérées par les macrophages. Les cellules phagocytaires reconnaissent des
modifications membranaires de la cellule apoptotique notamment des
phosphatidylsérines rapidement exposées à la face externe de la membrane de la
cellule apoptotique. La cellule ingérée est alors complètement dégradée et
digérée par le phagocyte.
Figure 13 : Système perforine/granzymeB.
D
- Molécules membranaires induisant l’apoptose des cellules cibles
La libération des granules lytiques est le mécanisme
effecteur principal de la cytotoxicité des lymphocytes T CD8+. La libération
des granules lytiques est un phénomène strictement dépendant des flux
calciques. Cependant, les lymphocytes T CD8+ ont encore un certain potentiel
cytotoxique même en absence de calcium. De plus, certains lymphocytes T CD4+ de
type Th1 sont doués de pouvoir cytotoxique bien que ces cellules ne contiennent
pas de granules lytiques. Ces observations montrent qu’il existe un mécanisme
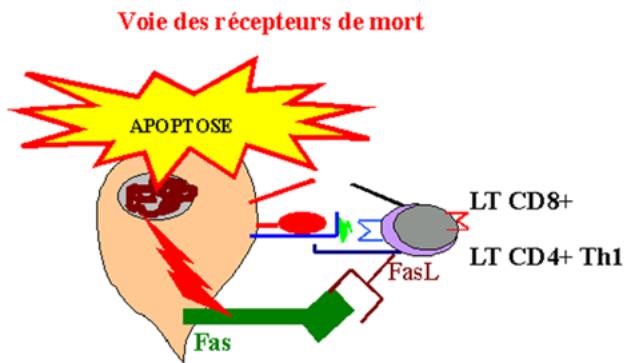
de toxicité indépendant du système perforine/granzyme. Ce mécanisme implique
l’interaction de FasL présent sur la cellule cytotoxique avec Fas exprimé à la
surface de la cellule cible. FasL est présent à la surface des lymphocytes T
CD8+ et CD4+ de type Th1. L’activation de Fas conduit à la mort par suicide
apoptotique de la cellule cible.
Figure 14 : Voie des récepteurs de mort.
E
– Rôle des cytokines
Les lymphocytes T CD8+ produisent des cytokines qui peuvent contribuer dans une certaine mesure à la défense anti-infectieuse de l’organisme. L’IFN-g inhibe directement la réplication virale et induit l’augmentation de l’expression des molécules du CMH augmentant par la même les chances de rencontre entre un complexe CMH-peptide avec le TcR porté par une cellule T spécifique. L’IFN-g active les macrophages et les recrute au site de l’infection où ces cellules pourront agir soit comme cellules effectrices, soit comme CPA.
Le TNF-a et -b produit par les cellules T CD8+ peut agir en synergie de l’IFN-g sur l’activation des macrophages. De plus, le TNF peut agir comme une molécule cytotoxique directement en se fixant sur son récepteur de mort TNF-R1.
F
– Spécificité des mécanismes cytotoxiques
Lorsque des lymphocytes T cytotoxiques sont mélangés avec deux types de cellules cibles, les premières exprimant l’antigène, les autres non, les cellules cytotoxiques ne détruisent que les premières. Les cellules voisines ne sont pas détruites même si les molécules effectrices libérées par la cellule cytotoxique ne sont pas spécifiques de l’antigène. L’explication de ce phénomène réside dans la libération hautement polarisée vers la cellule cible des molécules effectrices. Les granules lytiques sont libérés dans le micro-environnement créé par l’interaction des membranes des cellules cibles et effectrices.
VI – Activation des macrophages par les
lymphocytes Th1
A
– Introduction
De nombreux micro-organismes comme les mycobactéries sont des germes intracellulaires qui se multiplient dans les phago-lysosomes des macrophages. A ce niveau, ils sont protégés des anticorps et des cellules cytotoxiques. Les mycobactéries peuvent vivre dans ce milieu hostile en inhibant la fusion du phagolysosome et des lysosomes et en bloquant l’acidification des lysosomes. Ces micro-organismes peuvent être éliminés lorsque le macrophage est activé par un lymphocyte T CD4+ de type Th1. Les cellules Th1 activées synthétisent des protéines membranaires et solubles à action locale ou systémique qui vont pouvoir coordonner la réponse immunitaire vis à vis de ces pathogènes.
B
– Etapes de l’activation macrophagique
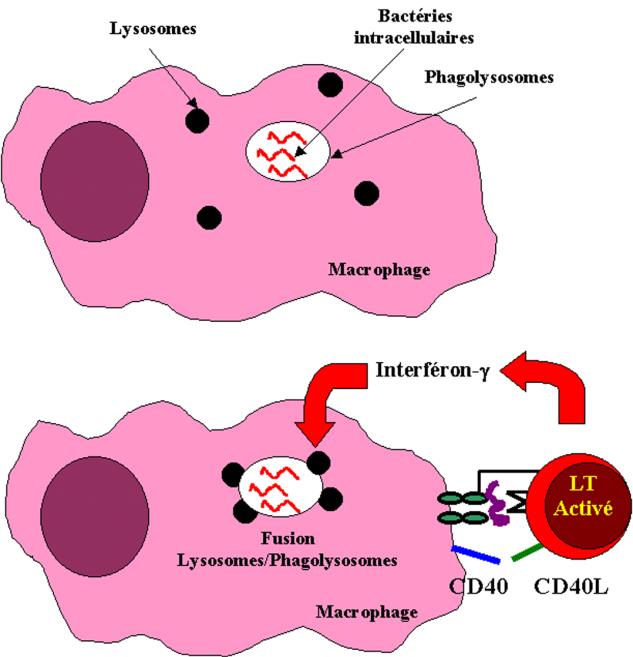
De nombreux mico-organismes présents dans le milieu extracellulaire sont captés par les macrophages. La majorité d’entre eux y sont détruits sans l’intervention des lymphocytes T. Cependant, dans certains cas, les pathogènes peuvent vivre et se multiplier à l’intérieur des macrophages. Dans ce cas, leur destruction nécessite la coopération des cellules T. L’induction des mécanismes anti-microbiens du macrophage est la principale fonction effectrice des lymphocytes T CD4+ de type Th1. L’activation des macrophages requiert deux signaux. Le premier est fourni par l’IFN-g, le second par des molécules qui abaissent le seuil de sensibilité du macrophage à l’IFN-g. Les deux signaux peuvent être fournis par les lymphocytes T CD4+ Th1.
L’IFN-g est la principale cytokine produite par les lymphocytes Th1 activés. Ces cellules expriment en outre la molécule CD40 Ligand qui interagit avec la protéine CD40 présente sur le macrophage. L’interaction CD40/CD40L sensibilise le macrophage à l’action de l’IFN-g. La sensibilité des macrophages à l’action de l’IFN-g peut aussi être augmentée par de faibles quantités de lipopolysaccharide bactérien. Les formes membranaires du TNF-a et b peuvent aussi se substituer à CD40L pour activer le macrophage. Les lymphocytes Th2 n’activent pas les macrophages. D’une part ces cellules ne produisent pas d’IFN-g et d’autre part, l’IL-10 sécrétée par les lymphocytes Th2 est la principale cytokine responsable de la désactivation des cellules macrophagiques. Cependant, les cellules Th2 expriment CD40L et peuvent donc induire dans une certaine mesure les signaux membranaires requis pour que le macrophage devienne sensible à l’action de l’IFN-g.
Les lymphocytes Th1 activent donc les macrophages infectés par des contacts cellulaires et la sécrétion polarisée d’IFN-g. Ceci génère une série de réponses biochimiques qui transforment le macrophage en cellule douée de capacité anti-microbienne. Au niveau du cytoplasme des macrophages activés on assiste à la fusion des phagosomes avec les lysosomes exposant ainsi les bactéries intracellulaires aux enzymes protéolytiques des lysosomes. Les macrophages activés produisent des radicaux libres et du monoxyde d’azote (NO) ayant chacun des activités bactéricides. En outre, le macrophage activé peut sécréter des peptides anti-microbiens (les défensines) qui peuvent détruire certains micro-organismes extracellulaires.
Certaines propriétés du macrophage activé comme l’augmentation de l’expression des molécules du CMH et des molécules B7 peuvent amplifier la réponse immunitaire en rendant le macrophage activé plus efficace pour activer les cellules T naïves. Le TNF-a agit aussi en synergie avec l’IFN-g dans l’activation du macrophage particulièrement dans l’induction de la production de NO en stimulant la NO synthase inductible.
Les macrophages activés sont particulièrement efficaces
pour détruire les pathogènes, toutefois, leur activation entraîne la libération
de nombreuses molécules toxiques non spécifiques responsables de dommages
tissulaires. L’activation des macrophages par les lymphocytes T CD4+ de type
Th1 doit donc être finement régulée pour permettre la destruction des cellules
infectées sans toutefois provoquer de dommages tissulaires trop importants. Le
contrôle de l’activation macrophagique afin d’éviter la destruction de tissus
normaux est assuré indirectement par les mécanismes régulant la production d’IFN-g. Il semble que ceci soit réalisé de deux manières.
Premièrement, les ARN codant l’IFN-g
contiennent dans leur région 3’ une zone d’instabilité qui diminue fortement la
demi-vie des transcrits de cette cytokine. Deuxièmement, l’activation des
lymphocytes T semble induire la synthèse de protéines intracellulaires
responsables de la dégradation des ARN messagers. En effet, le traitement des
cellules avec un inhibiteur de la synthèse protéique (cycloheximide) augmente
fortement la quantité des ARNm codant l’IFN-g. Finalement, la rapide
destruction des transcrits de l’IFN-g
associé à sa libération polarisée au contact du macrophage limite l’action au
seul macrophage infecté.
Figure 15 : Etapes de l’activation macrophagique.
C
– Les cellules Th1 coordonnent la réponse contre les pathogènes
intracellulaires.
L’activation du macrophage par l’IFN-g sécrété par les lymphocytes Th1 activés exprimant CD40L joue un rôle
central dans la défense de l’organisme contre les pathogènes qui prolifèrent
dans les vésicules macrophagiques. Cependant, si l’IFN-g et CD40L sont
probablement les molécules effectrices produites par les Th1 les plus efficaces
pour l’élimination des micro-organismes intracellulaires, la réponse
immunitaire contre ces pathogènes est plus complexe et d’autres cytokines
peuvent aussi jouer un rôle dans la coordination de la réponse immune
anti-infectieuse. Par exemple, les macrophages chroniquement infectés par des
bactéries intracellulaires deviennent insensibles à l’activation. Ces cellules
constituent donc un réservoir infectieux protégé de l’attaque du système
immunitaire. D’autres molécules exprimées par les lymphocytes Th1 peuvent alors
intervenir pour éliminer ces foyers infectieux. Le premier système implique la
voie Fas/FasL. Les lymphocytes Th1 expriment FasL, ces cellules peuvent donc
interagir avec Fas présent à la surface du macrophage et induire la mort de la
cellule infectée par apoptose.
Un autre rôle majeur des cellules Th1 est le recrutement
des cellules phagocytaires sur le site de l’infection. Les lymphocytes Th1
recrutent les macrophages par deux mécanismes. Premièrement, ces cellules
produisent des facteurs de croissance hématopoïétiques comme l’IL-3 et le
GM-CSF qui stimule la production de nouvelles cellules phagocytaires par la
moelle osseuse. Deuxièmement, le TNF-a
et b sécrété par les lymphocytes Th1
au site de l’infection modifie les propriétés des cellules endothéliales de
sorte que les cellules phagocytaires peuvent s’y fixer. Certaines chimiokines,
comme MCP-1 produite par les lymphocytes Th1, permettent alors la migration de
ces cellules phagocytaires à travers l’endothélium et leur migration jusqu’au
site d’inflammation. Lorsque le micro-organisme résiste aux effets microbicides
du macrophage activé, l’infection persistante peut induire des phénomènes
inflammatoires chroniques. Dans ce cas, on observe la formation d’un granulome
inflammatoire constitué au centre de la cellule macrophagique entouré de
lymphocytes T activés. Des cellules géantes provenant de la fusion de plusieurs
macrophages sont fréquemment observés au centre du granulome. Ce processus
permet de cloisonner les micro-organismes qui résistent à la destruction.
Figure 15 : Rôle des lymphocytes Th1 dans l’immunité anti-infectieuse.
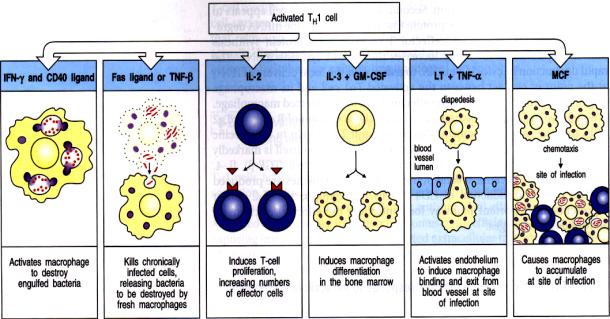
Photo :
Immunobiology, 1998, CA. Janeway. Ed Garland Publishing