![]()

Chapitre 12
LE SYSTEME DU COMPLEMENT
I- Introduction
Le système du complément est un ensemble de protéines ayant pour la plupart une activité enzymatique, et qui s’activent en cascade pour participer aux mécanismes de défense naturels de l'hôte contre l'infection et à la phase effectrice de la réponse immune spécifique.
Les protéines du complément sont synthétisées pour la plupart dans le foie sous forme inactive. Le système du complément comprend des protéines plasmatiques (composants et protéines régulatrices), des protéines membranaires de régulation. Des récepteurs cellulaires peuvent lier certaines protéines du complément ou leurs fragments d'activation. Deux voies d'activation sont connues depuis longtemps : la voie classique et la voie alterne, qui aboutissent à la formation de complexes enzymatiques macromoléculaires (C3 convertases), capables de cliver le composant C3. Il faut ajouter aujourd’hui une troisième voie, la voie de la " Mannose Binding Lectin " (MBL) qui rejoint la voie classique pour former la même C3 convertase. Les trois voies convergent dans la voie finale commune pour former le complexe lytique C5b9. La propriété cytotoxique du complexe C5b9 a été la première fonction biologique du complément décrite. En fait, de nombreux effets biologiques du complément ont depuis été mis en évidence qui dépendent pour la plupart de l'interaction des protéines du complément ou de leurs fragments d'activation avec des récepteurs cellulaires spécifîques.
Le système du complément a trois fonctions essentielles
: la défense contre l’infection, le maintien en solution et
l'élimination des complexes antigènes-anticorps, et la régulation
physiologique de la réponse immunitaire. Si l'activation du complément a
habituellement des effets bénéfiques, elle peut avoir également des effets
délétères et son activation incontrôlée peut être à l'origine d'effets
pathogènes.
Figure 1 : Voies d’activation du complément.
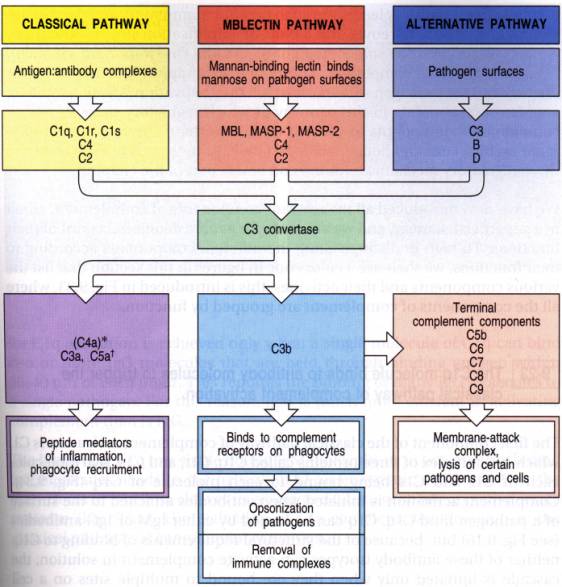
Photo :
Immunobiology, 1998, CA. Janeway, Ed Garland Publishing
II – Les protéines du complément et les voies d’activation
A-Formation de la C3 convertase de la
voie directe et de la voie de la MBL
La voie classique est, dans la grande majorité des cas, activée par les complexes antigènes - anticorps d'isotype IgG ou IgM. Elle peut également être activée, en l'absence d'anticorps, par des complexes héparine-protamine, des structures intracellulaires telles que les mitochondries, certaines bactéries gram-négatives telles que les salmonelles, ou des rétrovirus. Il a récemment été montré que la glycoprotéine d'enveloppe gp 120 du virus de l'immunodéficience humaine active la voie classique du complément en l'absence d'anticorps. La cascade de la voie directe comporte l’activation successive du complexe C1q, r, s , de C4 puis de C2, pour aboutir à la formation de la C3 convertase C4b 2a.
L'activation commence par la fixation du composant Clq sur le domaine CH2 du fragment Fc des IgG 1, 2 et 3 ou sur le domaine CH4 des IgM. Combinée à un antigène, la molécule Clq est associée, dans le complexe macromoléculaire Cl, à deux molécules de C1r et à deux molécules de C1s autour d'ions calcium. La molécule de C1q est formée de six sous-unités comportant chacune une région de type collagène et une région globulaire. C1q est correctement activé quand au moins deux poles globulaires sont fixés sur le Fc des immunoglobulines. Comme les IgG sont des monomères, il faut au moins deux molécules d’IgG pour fixer le C1q. En revanche, les IgM étant pentamériques, une seule molécule suffit.
La liaison de C1q à plusieurs molécules d'IgG ou à une molécule d'IgM libère le complexe C1 de son interaction physiologique avec le C1 inhibiteur. Ceci entraîne l'auto-activation des molécules C1r et C1s. Le composant C1s activé possède une activité sérine estérase, capable de cliver successivement les composants C4 et C2. La protéine C4 est clivée en un petit fragment anaphylatoxique C4a, libéré dans la circulation et un fragment majeur C4b qui se fixe de façon covalente sur la surface cible de l'activation. Le composant C2 s'associe au C4b et est clivé par l'enzyme C1s en un fragment C2a, restant associé à C4b et un fragment C2b libéré en phase fluide. Le composant C2 est une glycoprotéine constituée d'une seule chaîne de masse moléculaire 100kDa.
Une nouvelle voie d’activation a été décrite récemment, qui se greffe sur la voie directe au niveau de C4. La MBL est une lectine de type C dont la structure ressemble à celle de C1q et à la " C Reactive Protein ". Elles se combine à des radicaux comportant un mannose à la surface des agents infectieux et des cellules. Le complexe formé par MBL et sa cible active successivement deux sérine-estérases MASP-1 et MASP-2 (" MBL-Activated Serine Proteases " ; MASP-2 clive le C4 en C4a et en C4b qui se fixe à la surface de l’agent infectieux et rejoint alors la voie classique.
Ainsi se trouve formée sur la surface activatrice, la C3 convertase classique, C4b2a. Dans ce complexe bi-moléculaire, la sous-unité C2a possède l'activité enzymatique de clivage de C3.
La C3 convertase classique clive le composant C3 près de
son extrémité N terminale en libérant un petit fragment anaphylatoxique C3a et
un fragment majeur C3b. La molécule de C3b exprime un site labile de fixation
aux surfaces acceptrices et, par une réaction de transacylation, peut se lier
de façon covalente par un radical thiolester à un groupement hydroxyl ou aminé
de la surface acceptrice.
Figure 2 : Voie d’activation classique : Activation du C1s.
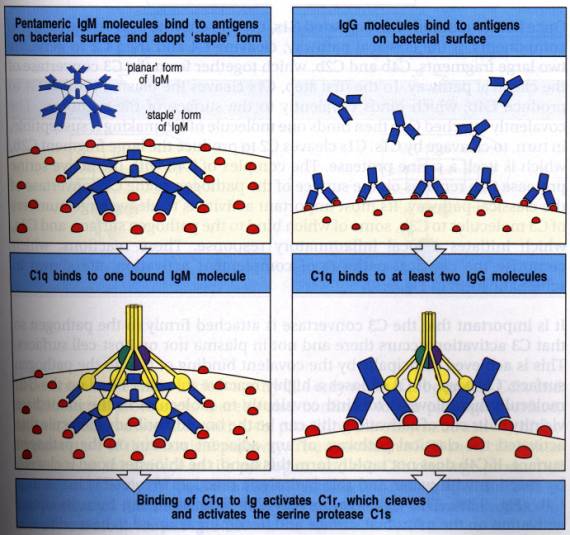
Photo :
Immunobiology, 1998, CA. Janeway, Ed Garland Publishing
Figure 3 : Voie d’activation classique : Activation de la C3 convertase.
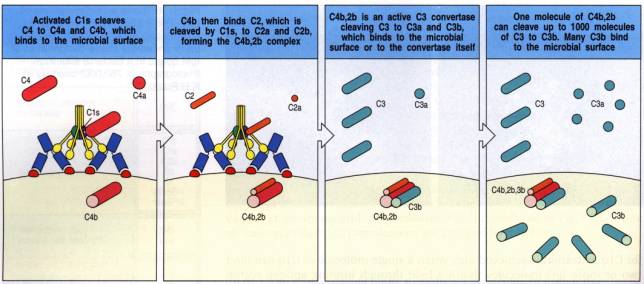
Photo :
Immunobiology, 1998, CA. Janeway, Ed Garland Publishing
B- Formation de la C3 convertase de la voie alterne
La voie alterne peut être activée en l'absence d'anticorps et constitue ainsi un système de résistance naturelle à l'infection. Les activateurs de la voie alterne sont d'origine bactérienne, virale, parasitaire ou il peut s'agir de cellules infectées par un virus. Si la voie alterne peut être activée en l'absence d'anticorps, la présence d'anticorps spécifiques augmente l'activation de la voie alterne.
La voie alterne fonctionne en permanence, mais au
ralenti : dans le plasma les protéines de la voie alterne, le C3 (ou sa
forme hydrolysée appelée "C3b like-C3"), le facteur B, le facteur D
et la properdine (P) interagissent faiblement pour former une C3 convertase
alterne dite "initiale" qui libère en permanence de petites quantités
de C3b dans la circulation. Les molécules de C3b nouvellement libérées
expriment un site labile de fixation covalente aux surfaces acceptrices.
Lorsque le C3b se fixe sur une surface dite "activatrice" de la voie
alterne, il s'associe au facteur B qui est ensuite clivé en deux fragments (Bb
et Ba) par le facteur D, sérine estérase présente sous forme active dans le
plasma. Le fragment Bb associé au C3b forme un complexe C3bBb fixé de façon
covalente à la surface activatrice. Ce complexe bimoléculaire est la C3
convertase alterne amplificatrice qui clive le C3 et libère de nombreuses
molécules de C3b qui iront à leur tour opsoniser la surface cible de
l'activation.
Figure 4 : Voie d’activation alterne : Activation de la C3
convertase.
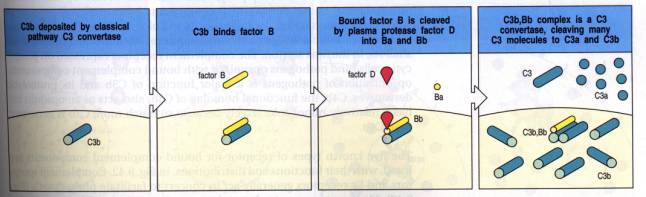
Photo :
Immunobiology, 1998, CA. Janeway, Ed Garland Publishing
C- La voie finale commune.
Le fragment C3b provenant du clivage de C3 par les C3 convertases classique et alterne peut :
l°
- participer à la boucle amplificatrice de la voie alterne
2°
- contribuer à la formation des C5 convertases
3°
- interagir avec le récepteur CR1 à la surface des cellules exprimant ce
récepteur
4° - être inactivé en C3bi par l'enzyme I en présence d'un cofacteur, la protéine H, ou le CR1. C3bi peut être à son tour clivé par le facteur I, en présence de CR1 comme cofacteur en un fragment C3dg qui reste lié de façon covalente à la surface cible de l'activation. C3dg représente le produit ultime de clivage de C3 dans le plasma et l'on peut détecter par exemple le C3dg sur des globules rouges de patients atteints d'anémie hémolytique à auto-anticorps froids. Dans les tissus, C3dg peut être dégradé en C3d et C3g.
L'accumulation de nombreuses molécules de C3b au voisinage
des C3 convertases classique ou alterne changent la spécificité des enzymes qui
deviennent capables de cliver le C5 (C5 convertases) en un petit fragment
anaphylatoxique C5a et un fragment majeur C5b. C5b peut lier le composant C6 ou
s'inactiver rapidement en phase fluide. Le complexe C5b6 lie C7 pour former un
complexe C5b-7 qui exprime un site d'insertion dans la double couche lipidique
des membranes cellulaires. C5b-7 peut ensuite lier une molécule de C8 et
plusieurs molécules C9. Ainsi se trouve formé le complexe membranaire C5b-9
(mC5b9). Ce complexe d'attaque constitue un tunnel transmembranaire hydrophile
qui provoque la lyse osmotique des cellules, des bactéries ou des virus qui ont
activé le complément. Le complexe C5b-9 peut être isolé après solubilisation de
la membrane par des détergents. En microscopie électronique, il a l'aspect d'un
cylindre creux portant un anneau à son extrémité extracellulaire.
Figure 5 : Voie finale commune : Activation de la C5 convertase.
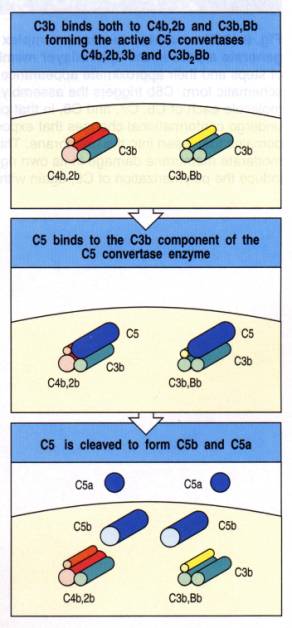
Photo :
Immunobiology, 1998, CA. Janeway, Ed Garland Publishing
Figure 6 : Voie finale commune : Formation du complexe d’attaque
membranaire.
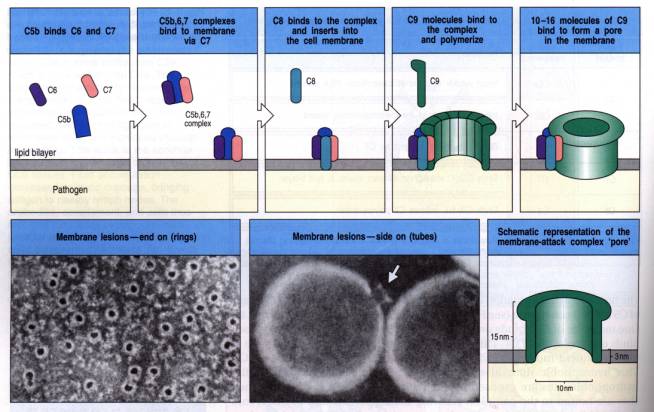
Photo :
Immunobiology, 1998, CA. Janeway, Ed Garland Publishing
III – Régulation de l’activation du complément
A - Régulation de l’activation de la
voie directe
L'activation de la voie directe est étroitement régulée :
L'activation de C1 est contrôlée par l'inhibiteur de C1 (C1inh), protéine présente dans le plasma sous forme active. C1inh empêche l'autoactivation de C1, dissocie le C1 de l'activateur de la voie classique en se combinant à C1r et à C1s pour former un complexe C1r-C1s-(C1inh)2.
L'activité enzymatique de la C3 convertase classique est contrôlée par plusieurs mécanismes.
-
Le
complexe C4b2a a une tendance spontanée à se dissocier, ce qui limite la durée
de vie de l'enzyme à la surface de l'activateur. Plusieurs protéines
plasmatiques ou membranaires ont une activité inhibitrice de la C3 convertase
classique dans le plasma.
- La C4 binding-protein ("C4bp") du fait de son affinité pour C4b, dissocie le complexe C4b2a et facilite le clivage de C4b par l'enzyme I ce qui aboutit à l'inactivation de C4b en C4bi.
Des molécules membranaires, accélèrent la dissociation de la C3 convertase classique: il s'agit du récepteur pour C3b (CR1, CD35), de la glycoprotéine gp45-70 et du DAF ("Decay Accelerating Factor'). Les molécules CR1 servent de co-facteur à l'enzyme I pour cliver de façon irréversible C3b et C4b en fragments hémolytiquement inactifs. Les gènes codant pour CR1 (et CR2) sont localisés dans le chromosome 1 dans une région codant également d'autres protéines régulatrices de l'activation du complément DAF, C4bp et H. CR1 (CD35) récepteur pour C3b est une glycoprotéine polymorphe exprimée chez l'homme à la surface des érythrocytes, des lymphocytes B, d'une sous-population lymphocytaire T (CD4+ ou CD8+), des monocytes-macrophages, des polynucléaires neutrophiles et éosinophiles, des cellules folliculaires dendritiques et des podocytes.Du fait de sa forte affinité pour le fragment C3b lié à une surface, CR1 est capable d'inhiber les C3 et C5 convertases classiques et alternes et de servir de cofacteur à l'inactivation de C3b en C3bi. CR1 exerce, par ailleurs, des fonctions biologiques diverses selon le type cellulaire qui exprime le récepteur.
B - Régulation de la voie alterne
La formation de la C3 convertase alterne est soumise à une régulation par les protéines inhibitrices H et I présentes sous forme active dans le plasma. Ces protéines préviennent également la formation d'une C3 convertase alterne dans le plasma. Si la surface sur laquelle le C3b s'est déposé est une surface "non activatrice" de la voie alterne, C3b fixera préférentiellement la protéine H plutôt que le facteur B prévenant ainsi la formation du complexe C3bBb. La protéine plasmatique H est, comme la molécule membranaire CR1, un cofacteur de I dans l'inactivation protéolytique de C3b en un fragment inactif C3bi. Au contraire, lorsque C3b est déposé sur une surface "activatrice", l'affinité de H est comparable à celle de B pour C3b et la formation de la C3 convertase peut être amplifiée. Différentes caractéristiques physico-chimiques de la surface, tel que le contenu en acide sialique détermine son caractère activateur ou non-activateur. Des surfaces pauvres en acide sialique sont activatrices de la voie alterne. La désialilation enzymatique ou la modification in situ de l'acide sialique membranaire transforme certaines surfaces en surfaces activatrices. A l'inverse, la richesse en acide sialique de la paroi de certaines bactéries leur permettent d'échapper temporairement au système du complément. Comme l'acide sialique, l'héparine et l'héparan-sulfate, constituant de certaines membranes cellulaires, augmentent l'affinité de C3b pour H et contribuent au caractère non activateur des surfaces qui expriment ces molécules.
Une fois formée, la C3 convertase alterne comme la C3 convertase classique clive de nombreuses molécules de C3b qui vont à leur tour se fixer sur la surface cible. La C3 convertase alterne est stabilisée par la properdine (facteur P) qui augmente la durée de vie de l'enzyme. La demi-vie de la C3 convertase alterne est en revanche limitée :
o par la dissociation spontanée du complexe qui peut également être accélérée par des molécules membranaires.
o Le récepteur pour C3b (CR1) prévient l'interaction de C3b avec le facteur B et se comporte ainsi comme un inhibiteur membranaire de l'activation du complément. Comme la protéine H, CR1 est capable de dissocier les C3 convertases classique et alterne et sert de cofacteur au facteur I dans l'inactivation de C4b et de C3b.
o Les protéines gp45-70 et le DAF limitent aussi la formation de la C3 convertase alterne.
C - Régulation de la voie finale
commune
Les cellules humaines sont protégées de la lyse par le complément autologue ou homologue par plusieurs mécanismes. Les protéines membranaires inhibitrices des C3 et C5 convertases, CR1, gp45-70 et DAF ont déjà été mentionnées. Les lipoprotéines plasmatiques de haute densité (HDL) inhibent l'insertion membranaire de C9. Les cellules de l'individu sont également protégées vis à vis de la lyse par le complément autologue ou homologue par une protéine membranaire HRF (Homologous Restriction Factor, CD59) qui prévient la polymérisation de C9 au contact de complexes m(C5b8) homologues ou autologues. CD59, comme le DAF est une glycoprotéine liée à la membrane par une ancre glycolipidique. Ces molécules sont absentes des globules rouges des patients atteints d'hémoglobinurie paroxystique noctume. Le déficit en DAF et HRF est ainsi responsable de la facilitation de la lyse par le complément des érythrocytes de ces patients.
Les cellules nucléées sont capables d'internaliser des complexes m-C5b9 insérés dans la membrane ce qui les rend plus résistantes que les érythrocytes vis à vis de la lyse par le complexe terminal. Si le complexe C5b7 formé ne trouve pas de membrane cellulaire à son voisinage, il s'associe dans le plasma à la protéine S (vitronectine). Ces complexes SC5b7, SC5b8 et SC5b9 sont incapables de s'insérer dans les membranes et sont donc cytolytiquement inactifs.
La cytotoxicité médiée par m-C5b9 s'exerce donc principalement vis à vis de cibles hétérologues telles que des bactéries, des virus et des parasites du fait des nombreux mécanismes protecteurs qui existent à la surface de cellules autologues. La fixation de complexe C5b9 en quantités sublytiques à la surface de ces cellules entraîne la synthèse et la libération des médiateurs de l'inflammation (leucotriènes, Interleukine-1).
Les agents infectieux notamment les bactéries ou les virus
ont une susceptibilité variable à la lyse par le complément humain selon les
possibilités d'insertion et de stabilisation du complexe dans la membrane.
Figure 8 : Régulation de l’activation du complément.
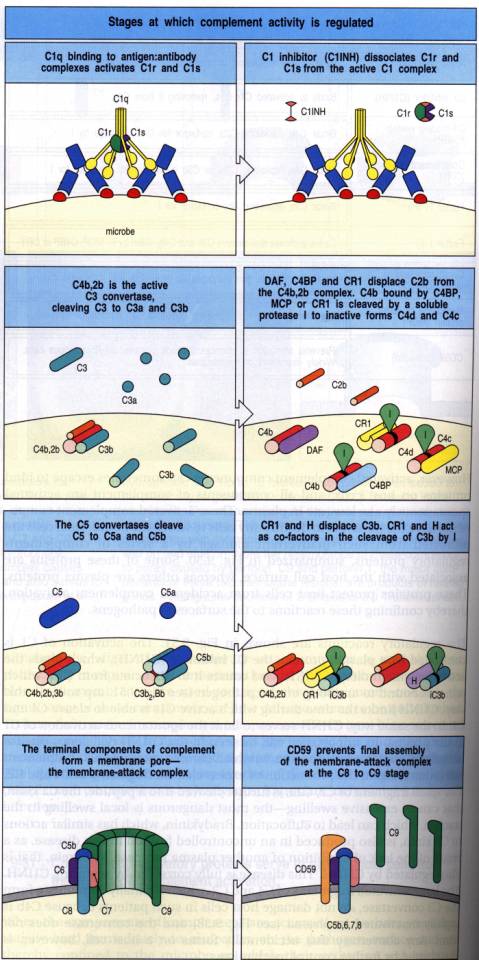
Photo :
Immunobiology, 1998, CA. Janeway, Ed Garland Publishing
IV – Le rôle du complément
A - Rôle dans la défense contre les infections :
Le complément intervient de différentes façons pour tuer et éliminer les agents infectieux : par son complexe d’attaque membranaire, il entraîne la lyse des bactéries, virus et parasites sur lesquels des anticorps spécifiques se sont fixés.Le fragment C3b se fixe d’une part sur le CR1 de l’agent pathogène, et d’autre part sur le CR1 des macrophages. IL permet ainsi la facilitation de la phagocytose : c’est le phénomène d’opsonisation. Le complément permet ainsi d’éliminer non seulement des microbes combinés aux anticorps spécifiques, mais les complexes antigène-anticorps en général.
Grâce aux propriétés chimiotactiques de C5a et de C5adesarg, un infiltrat de polynucléaires se constitute au lieu d’activation du complément, et facilite la phagocytose des agents infectieux. CR3 (CD11b/CD18), récepteur pour C3bi est un hétérodimère constitué de deux chaines polypeptidiques a (165 kDa) et b CD18 (95 kDa). La chaîne b est commune à deux autres molécules de surfaces leucocytaire LFA-1 et pl50-95 (CR4), présentes à la membrane des phagocytes et capable d'interagir avec C3bi et C3dg. Ces molécules sont des protéines adhésives donnant un sous-groupe parmi les intégrines. Le fragment C3bi possède une séquence Arg-Gly-Asp (RDG) caractéristique des ligands des intégrines. CR3 est exprimé à la surface des monocytes/macrophages, des polynucléaires neutrophiles et éosinophiles, des cellules folliculaires dendritiques, des grands lymphocytes à granules à activité naturelle tueuse (NK) et des cellules impliquées dans la cytotoxicité anticorps-dépendante. La molécule CR3 joue un rôle important dans la phagocytose, la cytotoxicité anticorps-dépendante et la cytotoxicité médiée par les cellules NK. Cette fonction est illustrée par la présence de nombreuses anomalies fonctionnelles des cellules phagocytaires et la survenue d'infections bactériennes à répétition chez les sujets présentant un déficit génétique en chaîine bêta commune et qui n'expriment pas ces récepteurs.
La fixation de C3b et C4b sur le CR1 ainsi que celle de C3bi sur le CR2, stimulent les lymphocytes B et accroît la production d’anticorps, tout comme la fixation de C5a sur les monocytes. CR2 (CD21), récepteur pour C3dg/C3d est exprimé à la surface des lymphocytes B, des cellules folliculaires dendritiques (qui expriment les trois types de récepteurs C3) et 40% environ des lymphocytes T du sang périphérique. CR1 est également le récepteur pour le virus d'Epstein-Barr (EBV). La liaison de C3d ou de l'EBV au récepteur CR2 des lymphocytes B peut induire ou augmenter la prolifération de ces cellules préactivées ou cultivées en présence d'autres stimuli. L'expression de cette molécule est diminuée à la surface des lymphocytes B de patients atteints de LED. Les fonctions de CR2, exprimé à la membrane des lymphocytes T, sont mal connues. La molécule CR2 est capable de médier la pénétration du VIH dans des cellules de lignées T, indépendamment de la molécule CD4.
B - La clairance des complexes
immuns
Ce rôle du complément est essentiel : la fixation de C4b et C3b sur les complexes immuns empêche leur dépôt tissulaire.. Cette fonction importante est illustrée par la fréquence des maladies dites "à complexes immuns" chez les sujets déficitaires en protéines précoces de la voie classique.
C - Effets adventices
Les anaphylatoxines C3a et C5a sont produites lors du clivage de C3 et C5. Elles sont rapidement inactivées dans le plasma en dérivés desarginés, C3adesArg et C5adesArg par l'action de la carboxypeptidase N. L'anaphylatoxine C3a induit la dégranulation des mastocytes et des basophiles et la libération d'histamine. La liaison de C3a aux monocytes entraine la production et la libération d'interleukine-1 (IL-1). Néanmoins, C3a a un effet global suppresseur sur la réponse immunitaire.
C5a et C5adesArg sont doués de propriétés chimiotactiques vis à vis des neutrophiles, des éosinophiles et des monocytes. La liaison de C5a et de C5adesArg à des récepteurs spécifiques sur les neutrophiles et les monocytes entraîne la stimulation du métabolisme oxydatif de ces cellules, la libération d'enzymes granulaires et l'augmentation de l'expression membranaire de certains récepteurs tels que CR1 et CR3. Du fait de ces propriétés, l’activation par C5a attire les phagocytes au site de l'inflammation et leur confèrent des propriétés effectrices.
Certaines membranes d’hémodialyse telles que les membranes de cuprophane activent la voie alterne du complément. Une augmentation rapide du C3a plasmatique, maximale à 15 minutes d'hémodialyse sur membrane de cuprophane coïncide avec une leucopénie. Cette leucopénie résulte au moins en partie de la séquestration pulmonaire des granulocytes secondaire à l'augmentation de l'expression des protéines adhésives leucocytaires (CR3) induite par la libération de C5a.
La liaison de C5a aux monocytes humains induit la production d'IL-1. C5a augmente la réponse anticorps spécifique in vitro et in vivo .
Figure 9 : Rôle des anaphylatoxine.
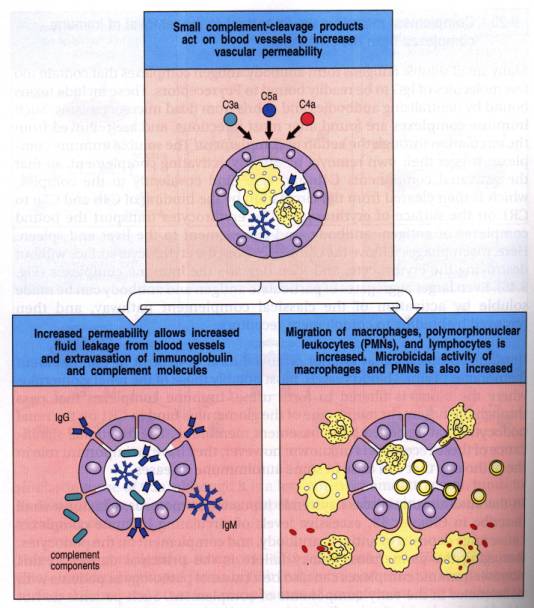
Photo :
Immunobiology, 1998, CA. Janeway, Ed Garland Publishing
V – Les déficits en fractions du complément
A - Déficits
en C1 inhibiteur
Le déficit en C1 inhibiteur est responsable de l'œdème angioneurotique. L’œdème angio-neurotique ressemble cliniquement à l’œdème de Quincke. Il s’en distingue par deux traits essentiels :
· les facteurs déclenchants ne sont pas spécifiques comme dans l’allergie de type I, mais au contraire aléatoires. Les micro-traumatismes muqueux, comme par exemple les soins dentaires, peuvent favoriser la survenue de crises.
· Il existe généralement d’autres cas dans la famille.
Ce déficit, lorsqu'il est héréditaire, est transmis selon le mode autosomique dominant ; il s'exprime donc chez les sujets hétérozygotes. Il peut s'agir d'un déficit quantitatif en C1 inhibiteur (déficit de type 1, caractérisé par un taux de protéines C1 inh, mesuré par des méthodes immunochimiques diminué) ou d'un déficit qualitatif (déficit de type II, protéine dysfonctionnelle). Le déficit en C1 inhibiteur entraîne une activation de C1 avec au moment des poussées un clivage du C4 et du C2. Le diagnostic repose sur le dosage quantitatif et/ou fonctionnel de CI inhibiteur. Le déficit en C1 inhibiteur peut être acquis.
Dans certains cas, il est possible de détecter dans le
sérum des autoanticorps anti-C1 inhibiteur. Ce déficit acquis survient plutôt chez
l'adulte et doit faire rechercher une pathologie sousjacente, notamment un
syndrome lympho-prolifératif.
Figure 10 : l'œdème angioneurotique.
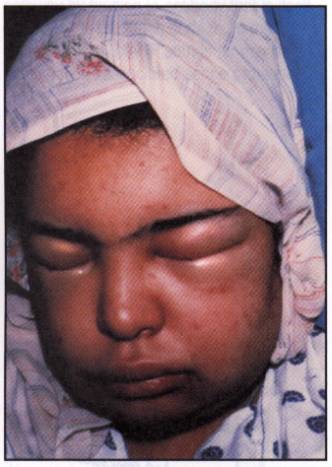
Photo :
Case studies in immunology, 2001, F. Rosen, Ed Garland Publishing
Figure 11 : mécanisme de l'œdème angioneurotique.
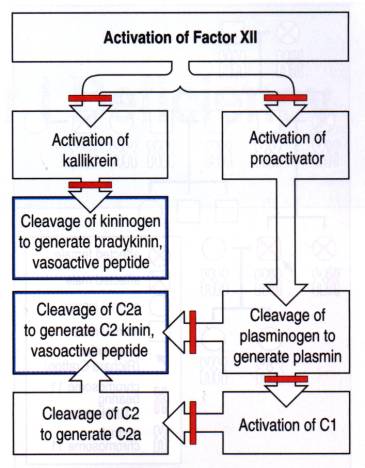
Photo :
Case studies in immunology, 2001, F. Rosen, Ed Garland Publishing
B - Déficits
en C2
Le composant C2 est codé par un gène situé à l'intérieur du complexe majeur d'histocompatibilité. La fréquence de l'allèle nul de C2 (C2Q0) est d'environ 1% dans la population générale. Il existe un déséquilibre de liaison entre l'haplotype HLA A 10, B 18 et DR2 et la présence d'un allèle nul de C2. Le déficit homozygote en C2 est le déficit complet en protéine du complément le plus fréquemment observé dans la population caucasienne (entre 1 sur 10.000 et 1 sur 30.000). Quarante % des patients présentant un déficit homozygote en C2 développent une maladie apparentée au lupus. Le déficit en C2 est également associé à une fréquence accrue d'infections.
C - Déficits
en C4
Le C4 est une protéine polymorphe composée de trois chaînes liées par des ponts disulfures. Chez l'homme, 2 isotypes de C4, C4A et C4B sont codés par deux gènes très liés dans le complexe majeur d'histocompatibilité. Les isotypes C4A et C4B sont tous deux capables de participer à la formation de la C3 convertase classique. Cependant, l'isotype C4B se fixe avec une plus forte avidité sur les groupements hydroxyles des globules rouges de mouton par exemple (activité hémolytique) que l'isotype C4A. Inversement C4A se fixe mieux que C4B sur les complexes immuns ce qui le rend plus efficace à inhiber la précipitation des complexes antigènes - anticorps.
Les déficits partiels en C4 sont très fréquents dans la population générale ; en effet 40 % des sujets normaux sont porteurs d'un allèle nul de C4. Ces allèles nuls appelés C4AQ0 ou C4BQ0 sont dus le plus souvent à une délétion au niveau de l'ADN génomique. Le déficit en C4A prédispose à la survenue de lupus érythémateux disséminé (LED) ou de maladies apparentées. Plusieurs études ont mis en évidence que 10 à 16 % des patients présentant un LED ont un déficit homozygote en C4A. Le risque relatif pour un sujet atteint de déficit homozygote en C4A de développer un LED est estimé à 15 - 20 fois supérieur à la population normale. En revanche, le déficit homozygote en C4B ne semble pas être présent avec une fréquence accrue chez les lupiques. Deux mécanismes ont principalement été discutés comme étant à l'origine de l'association entre les déficits en C2 ou C4 et la survenue de maladies auto-immunes. Certains haplotypes HLA, prédisposant à la survenue de maladies auto-immunes sont en déséquilibre de liaison avec l'allèle nul C4AQ0. Néanmoins, des études ont montré que la présence des allèles C4AQ0 constituent un risque indépendant de l'association à un haplotype HLA particulier. Il est donc très vraisemblable que ce déficit favorise la maladie par la diminution de la capacité du sérum à inhiber la précipitation des complexes immuns en l'absence de ces protéines.
Les poussées lupiques s'accompagnent fréquemment d'un syndrome de consommation par la voie classique. L'association hypocomplémentémie de consommation et déficit en protéines du complément est très fréquente au cours du LED. Ainsi, l'hypocomplémentémie peut-elle être le reflet d'une consommation des protéines du complément et/ou d'un déficit. La fréquence des déficits C2 et C4 au cours du LED implique que l'abaissement des protéines C4 ou C2 ne peut seul être considéré comme un indice d'activité du LED. Le phénotypage de C4, pratiqué en dehors des épisodes de consommation peut aider au diagnostic de déficit partiel en C4 et en C2. En effet, il existe un déséquilibre de liaison entre le complotype C4A4B2 et l'allèle nul C2Q0. Le phénotype HLA peut également être utile pour le diagnostic de déficit hérérozygote en C2. Le déficit hétérozygote en C4 et en C2 peut cependant être difficile à caractériser en l'absence de génotypage C4 et C2, techniques lourdes qui sont elles-mêmes parfois mises en défaut. L'étude familiale est toujours d'un apport considérable au diagnostic.
D - Déficits
en C3
Les déficits congénitaux en C3 sont rares. Ils sont associés à la survenue d'infections bactériennes à répétition et de glomérulonéphrites.
E - Déficits
en C5-8
Les déficits en composants de la séquence terminale C5-C8 se compliquent d'infections bactériennes, notamment d'infections récidivantes à Neisseria meningitidis.
F - C3NeF
Dans certaines pathologies telles que les glomérulonéphrites membranoprolifératives et la lipodystrophie partielle, un facteur néphritique (C3NeF) est souvent mis en évidence dans le sérum. Le C3NeF est un autoanticorps d'isotype IgG capable de se fixer sur la C3 convertase alterne et de prolonger sa demi-vie sérique. Les C3NeF induisent, par la stabilisation de la C3 convertase alterne, une consommation du C3 et du facteur B. La présence d'un C3 NeF s'accompagne d'un déficit acquis en C3, comme les déficits en protéines régulatrices de la voie alterne (facteurs H et I). Ces déficits se compliquent d'infections bactériennes récidivantes. Le déficit en protéine H a également été associé a la survenue d'un syndrome hémolytique et urémique (SHU).
G - Déficits
en CR1
La diminution de l'expression de CR1 à la surface des érythrocytes pourrait être ainsi responsable d'un défaut du métabolisme des complexes immuns circulants. L'expression quantitative de CR1 à la surface des érythrocytes est génétiquement déterminée par un élément régulateur proche du gène de structure de CR1. Deux allèles codent pour l'expression d'un fort ou d'un faible nombre de récepteurs et sont transmis de façon autosomale codominante. La fréquence du phénotype "faible nombre de récepteurs" est de 53 % chez les lupiques alors qu'elle n'est que de 12 % dans la population générale. Les études génotypiques par analyse du polymorphisme de restriction (RFLP) montrent que le déficit d'expression de CR1 à la surface des érythrocvtes des patients atteints de LED est avant tout un phénomène acquis. Le déficit en CR1 n'est donc pas un facteur prédisposant à la survenue d'un lupus mais serait un témoin de l'évolutivité de la maladie et un facteur aggravant du défaut de clearance des complexes immuns. Au cours du lupus, l'expression de CR1 est également diminuée à la membrane des neutrophiles, des lymphocytes B ainsi que sur les podocytes dans les formes prolifératives sévères de glomérulopathies lupiques.
VI - Exploration du système complément.
Toutes les explorations in vitro du complément doivent être réalisées sur du sérum frais ou du sérum conservé à – 70°C à cause de la thermolabilité de certaines fractions. La concentration plasmatique des protéines du complément traduit l’équilibre entre leur production et leur consommation.
Une augmentation de la concentration plasmatique des protéines du complément et de leur activité fonctionnelle est observée dans les syndromes inflammatoires et traduit une synthèse accrue. Une hypocomplémentémie témoigne soit d'une activation in vivo de la cascade du complément et ainsi d'une consommation de ces composants, soit d'un déficit congénital en l'un des composants, soit de l'association d'un déficit et d'une consommation, association fréquente au cours des maladies auto-immunes.
A - Dosage
fonctionnel global : complément hémolytique 50% (CH50)
Le CH 50 est un test hémolytique qui explore l'activité fonctionnelle de la voie classique et de la voie finale commune. Le CH50 est la plus petite quantité de sérum frais capable d'entraîner la lyse de 50 % d’une suspension d'hématies de mouton sensibilisées de façon optimale par des anticorps anti-hématies. Les résultats peuvent être exprimés en pourcentage par rapport à la lyse obtenue en présence d'un pool de plasmas provenant de sujets normaux. Le laboratoire doit toujours indiquer les normes de ses résultats.
· L’ élévation du CH50 traduit l’existence d’un syndrome inflammatoire, quelle que soit son étiologie.
· L’abaissement du CH50 signifie :
· Soit une pré-activation in vivo dans le sérum du patient avant le pélèvement : par exemple au cours d’une connectivite comme le lupus érythémateux disséminé ; la consommation de certaines fractions résulte alors en une inefficacité in vitro.
· Soit un déficit quantitatif (fonctionnel) ou quantitatif d’une ou plusieurs fractions.
Le CH50 est un test très utile pour le dépistage des déficits homozygotes en composant du complément. Dans ce cas, le CH50 est nul ou très abaissé. Le déficit en C1 inhibiteur est évoqué devant une baisse du CH50, du C4 et du C2 avec un C3 normal. Le C1 inhibiteur peut être dosé par méthode immunochimique (néphélémétrie ou immunodiffusion radiale) et par un test fonctionnel d'inhibition de C 1.
Dans des circonstances expérimentales où l’on ne souhaite pas que l’activation du complément interfère avec d’autres mécanismes, on peut inactiver le complément en chauffant le sérum à 56°C pendant 30 mn.
B - Dosage
pondéral des fractions
La détection d’une diminution quantitative d’une ou plusieurs fractions se fait par dosage pondéral par immuno-diffusion radiale, en néphélométrie, ou par ELISA. Cette diminution peut traduire l’activation in vivo de la voie si C2, C4 et C3. sont abaissés L'activation isolée de la voie alterne induit une diminution des taux de C3 et de facteur B sans modification des taux de C2 et C4. . Cependant, une activation majeure de la voie classique peut s'accompagner d'un recrutement de la voie alterne, amplifiant la consommation de C3.
Le dosage systématique de C4, C2 et du facteur B, associé au dosage du CH50, permet non seulement d’étudier les fractions les plus souvent déficitaires ( C4 et C2) , mais aussi de contrôler le CH50.
C - Etude du
polymorphisme
L’étiologie du déficit quantitatif d’une peut être précisée grâce à l’tude du polymorphisme génétique de cette fraction. Avant d’entreprendre cette étude, il convient de vérifier par des dosages répétés, la constance de la diminution de la fraction.
Le polymorphisme génétique de C2, C4 et B peut être étudié par électrophorèse ou isoélectrofocalisation et révélation par immunofixation ou hémolyse. L'étude du polymorphisme de C4 permet de déterminer le nombre d'allèles de C4 exprimés, d'autant qu'il n'existe pas de corrélation étroite entre le taux mesuré de C4 et le nombre d'allèles exprimés. L'étude du polymorphisme de C4 est beaucoup plus difficile lorsqu'il existe une diminution du taux de C4 du fait d'une consommation in vivo . De nouvelles techniques peuvent aider au diagnostic de déficit en C4 : il s'agit de l'étude de la longueur des fragments d'ADN après digestion par des enzymes de restriction (RFLP) qui permettent de rechercher une délétion au niveau de l'ADN. Le polymorphisme de la protéine C2 est beaucoup plus restreint. L'allèle nul de C2 est transmis en déséquilibre de liaison avec le complotype C4A4B2 et l'haplotype HLA A10 (A25), B18, DR2). Si le diagnostic de déficit homozygote en C2 est habituellement facile, le diagnostic de déficit hétérozygote en C2 peut être plus difficile. L'enquête familiale, le phénotypage de la protéine C4 et le phénotypage HLA pourront être utiles au diagnostic. En effet, ce diagnostic peut être rendu encore plus difficile
D - Dosage
fonctionnel individuel des fractions
C’est un dosage complexe auquel on ne recourt que dans les cas rares où le CH50 est abaissé à plusieurs reprises sans diminution quantitative des fractions.
L'activité fonctionnelle de chaque composant peut être mesurée individuellement par des tests hémolytiques qui reposent sur un principe commun : les globules rouges de mouton recouverts des composants précédant le composant à doser, par exemple EAC1-4 pour le dosage de C2 , sont incubés en présence du sérum à tester. On ajoute ensuite les composants C3 à C9 en excès en excès. Le degré d'hémolyse sera directement proportionnel à l’activité de C2.
E -
L'immunofluorescence directe ou indirecte sur des coupes
tissulaires
L'immunofluorescence directe ou indirecte sur des coupes tissulaires utilisant une combinaison de plusieurs anticorps dirigés contre des protéines du complément et /ou des anticorps monoclonaux spécifiques des néo-antigènes de fragments ou de complexes d'activation (C5b9) permet de démontrer une activation du complément in situ aux sites des lésions.