![]()

Chapitre 13
DIAGNOSTIC D'UNE IMMUNOGLOBULINE
MONOCLONALE
La détection d'une immunoglobuline monoclonale dans le sérum d'un patient est un signe d'alerte qui doit faire suspecter un syndrome lymphoprolifératif de la lignée B. Les investigations complémentaires doivent être poursuivies tant que la preuve de la bénignité n'a pas été apportée.
Les étiologies les plus fréquentes sont le myélome multiple (maladie de Kahler) et la macroglobulinémie de Waldenström. D'autres maladies, exceptionnelles, seront citées en fin de chapitre.
Un certain nombre d'immunoglobulines monoclonales surviennent isolément et ne sont pas secondaires à un syndrome lymphoprolifératif; on les appelle "immunoglobulines monoclonales bénignes". Elles nécessitent une surveillance régulière.
I - Le myélome
A - Rappel
clinique
Le myélome, ou maladie de Kahler, est une hémopathie maligne à localisation osseuse, caractérisée par une prolifération monoclonale de plasmocytes secrétant une immunoglobuline retrouvée dans le sang. Cette prolifération tumorale maligne entraîne une ostéolyse. Le myélome est une affection maligne rare (moins de 0,03 % des cancers; environ 3% des tumeurs malignes des os), survenant dans la deuxième moitié de la vie, à partir de 40 ans, exceptionnellement avant 30 ans, rarement après 70 ans. Le myélome atteint avec une égale fréquence l'homme et la femme. La prolifération plasmocytaire est généralement diffuse (myélome multiple); dans moins de 5% des cas elle est localisée en un point du squelette (plasmocytome solitaire). Les localisations préférentielles sont les suivantes:
- voûte crânienne, rachis, côtes et pelvis : 60 à 75 % des cas.
- os longs (notamment fémur et humérus), ceinture scapulaire et sternum : 40 à 50 % des cas.
Chez 80% des malades ce sont des douleurs osseuses, tantôt localisées au point où se développe l'ostéolyse, tantôt diffuses. Elles suivent parfois un trajet radiculaire, notamment aux membres inférieurs lorsqu'une racine sciatique ou crurale est comprimée par l'affaissement d'une vertèbre ou par la tumeur elle-même. Les fractures, spontanées ou provoquées par un traumatisme minime, sont révélatrices du myélome chez 5% des patients seulement, mais elles sont observées par la suite chez près de la moitié des malades.La lésion radiologique la plus typique est la géode à l'emporte-pièce, c'est-à-dire sans liseré de condensation périphérique. La taille en est variable: le plus souvent petite avec multiples localisations au crâne, parfois volumineuse au bassin ou sur les os longs (pouvant effacer toute structure osseuse sur une grande surface et encocher les corticales). Sur le rachis les images géodiques sont rares. Le plus souvent existe une hypertransparence osseuse diffuse identique sur les clichés à celle d'une ostéoporose sévère. Cette forme particulière a reçu le nom de myélomatose décalcifiante diffuse. Des lésions "soufflantes" sont plus rares et siégent plutôt au niveau des os plats comme les côtes.
Au
cours de l'évolution, les signes précédents s'intensifient ou se multiplient.
Apparaît une altération de l'état général avec parfois une fébricule, et des
complications infectieuses ou neurologiques surviennent.
Figure 1 : Prolifération tumorale maligne au niveau de l’extrémité
supérieure de l’humérus observée au cours d’un myelome.
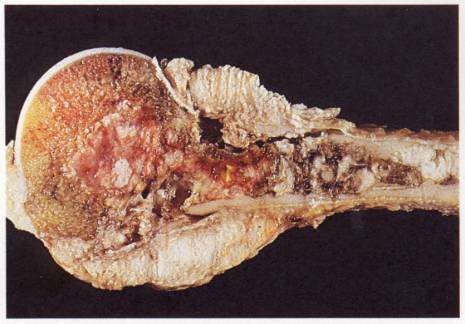
Photo :
M Thulliez
Figure 2 : Images radiologiques du myelome multiple
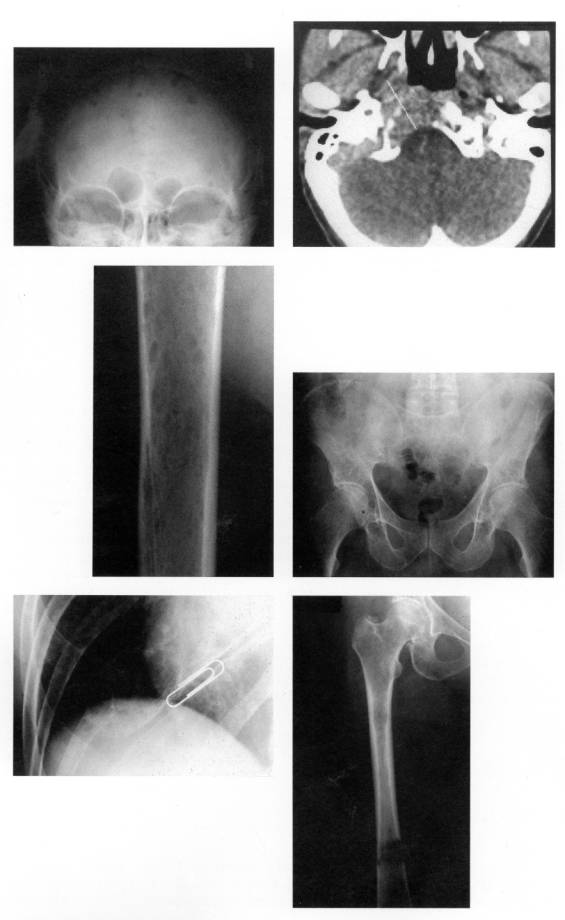
Photo : B Weill
B -
Diagnostic biologique
Le diagnostic de myélome multiple est soupçonné sur:
- Une VS très accélérée (généralement > 100 mm à la première heure);
- la constatation d'une pic élevé et étroit dans les immunoglobulines à l'électrophorèse des protides sériques. Parfois le pic est observé dans la zone des béta voire des alpha 2 globulines; quel que soit son emplacement, un pic étroit doit faire soupçonnner le diagnostic et prescrire une immuno-électrophorèse (I.E.P.) ou une immunofixation.
- L'immuno-électrophorèse ou l'immunofixation du sérum et des urines (concentrées) permet seule de confirmer le diagnostic d'immunoglobuline monoclonale (IgG dans 50 à 60 % des cas;
IgA dans 20 à 30 % des cas; exceptionnellement IgD ou IgE). Grâce à l'I.E.P. on détecte aussi des chaînes légères kappa (2/3 des cas) ou lamda (1/3 des cas) dans les urines. (C'est la protéinurie de Bence Hones).
- Un dosage pondéral des autres immunoglobulines sériques montre toujours dans le myélome une diminution de leur concentration.
- Le myélogramme objective la prolifération plasmocytaire qui représente plus de 20 % des cellules médullaires.
- La biopsie médullaire (crête iliaque) n'est pas nécessaire au diagnostic quand le myélogramme est caractéristique. Elle n'est réalisée qu'en cas de doute.
Quelques cas particuliers rendent plus difficile le diagnostic :
1 - Le plasmocytome solitaire : il est rarement accompagné d'anomalies biologiques; lorsqu'on découvre une immunoglobuline monoclonale dans le sérum, elle est à un taux faible et disparaît le plus souvent après traitement de cette tumeur isolée. L'I.E.P. et l'immunofixation, permettant de guetter la réapparition de cette globuline constituent un bon moyen de dépister une récidive. Le myélogramme et la biopsie médullaire sont normaux.
2 - Le myélome à chaînes légères (10 à 20 % des cas) se caractérise par la présence de fragments de chaînes légères dans le sérum et non de molécules complètes d'immunoglobulines. Il ne faut pas se laisser abuser par l'accélération modérée de la VS (vers 30 mm) ni par l'absence possible de pic à l'électrophorèse. C'est là encore l'I.E.P. ou l'immunofixation du sérum et des urines et le myélogramme qui permettront d'affirmer le diagnostic.
3 - Le myélome non secrétant est le plus trompeur biologiquement par:
- l'absence d'accélération de la VS (ou son accélération modérée);
- l'absence de pic à l'électrophorèse;
- l'absence d'immunoglobuline monoclonale dans le sérum et dans l'urine;
- l'absence de protéinurie de Bence Jones.
On note cependant dans 80 % des cas une diminution globale de la concentration des immunoglobulines dans le sérum.
Le
myélogramme demeure l'examen clef car il objective la prolifération
plasmocytaire. Le caractère monoclonal de cette prolifération est démontré par
immuno-fluorescence sur une biopsie médullaire: le cytoplasme de tous les
plasmocytes de la moelle contient la même molécule d'immunoglobuline (souvent
une IgA kappa) mais ils sont incapables de la sécréter.
Figure 3 : Prolifération plasmocytaire.
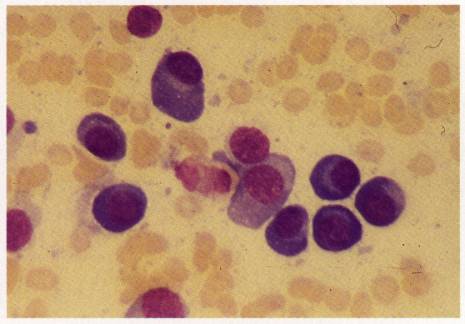
Photo : M Thulliez
Figure 4 : Diagnostic immunologique du myelome multiple : pic à l’électrophorèse
des protéines et immunofixation montrant la présence d’une IgG monoclonale de
type g2k2
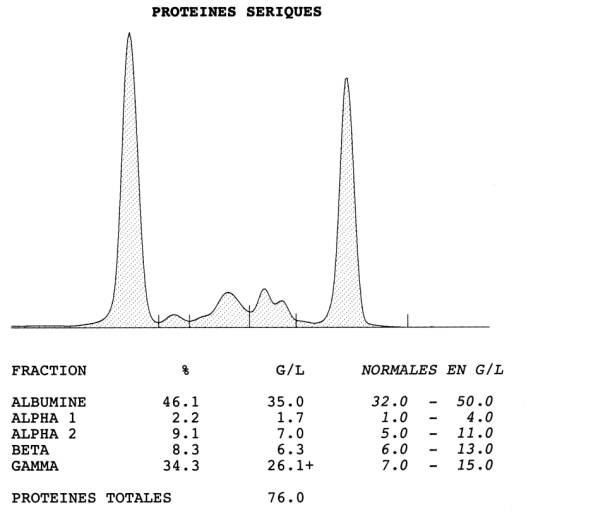
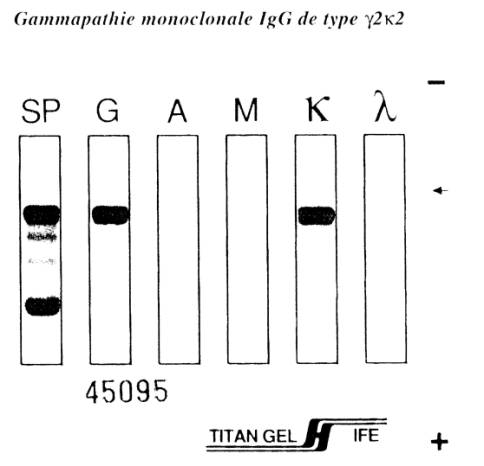
Figure : M Marien
II - Macroglobulinémie de Waldenström
A - Rappel
clinique
La macroglobulinémie de Waldenström atteint plus souvent les hommes que les femmes, entre 50 et 70 ans. Elle se présente cliniquement comme la leucémie lymphoïde chronique (LLC), avec des adénopathies superficielles et profondes, et une hépato-splénopmégalie. Le diagnostic différentiel entre LLC et maladie de Waldenström est parfois difficile car, dans les deux cas, il d'agit d'une prolifération lymphocytaire monoclonale. C'est la présence d'une IgM monoclonale sérique qui caractérise la maladie de Waldenström, mais une telle immunoglobuline monoclonale peut être observée aussi déans environ 10% des LLC. L'hyperlymphocytose est inconstante et généralement moindre qu'au cours d'une LLC, mais la plupart des lyphocytes circulants appartiennent au même clone.
Dans certains cas, l'IgM monoclonale est une cryoglobuline (cf chapitre "diagnostic d'une cryoglobuline"); parfois elle a une activité auto-anticorps (dirigée le plus souvent contre l'antigène I des hématies) et entraîne une anémie hémolytique auto-immune appelée "maladie des agglutinines froides".
B -
Diagnostic biologique
- la vitesse de sédimentation est constamment accélérée
- la protidémie est élevée. Lorsque la concentration de l'IgM monoclonale est très élevée, elle peut entraîner un syndrome d'hyperviscosité avec de graves troubles neurologiques. Simultanément, on observe une hémodilution.
- L'électrophorèse révèle un grand pic étroit en position g (ou parfois b2 à cause de la polymérisation des molécules).
- L' immunoélectrophorèse et l'immunofixation permettent de déterminer la classe IgM et la monoclonalité de la molécule. Lorsque l'IgM est euglobulinique, elle tend à précipiter dans le réservoir de départ et une dépolymérisation préalable est nécessaire à l'étude immunochimique. La concentration des chaînes légères monoclonales dans les urines (protéinurie de Bence Jones) est généralement plus faible que dans le myélome.
- L'immuno-précipitation radiale montre une diminution de la concentration des immunoglobulines normales.
- Le myélogramme montre une infiltration lymphoïde de la moelle, par un mélange de lymphocytes, de plasmocytes (<15%) et de formes intermédiaires lympho-pasmocytaires. Toutes ces cellules synthétisent la même IgM et les moins matures synthétisent aussi une IgD comportant la même chaîne légère et le même idiotype que l'IgM.
-
La biopsie médullaire (crête iliaque) n'est pas nécessaire au diagnostic quand
le myélogramme est caractéristique. Elle n'est réalisée qu'en cas de doute.
Figure 5 : Diagnostic immunologique de la macroglobulinémie de
Waldenström : immunofixation montrant la présence d’une IgM monoclonale de
type m2k2
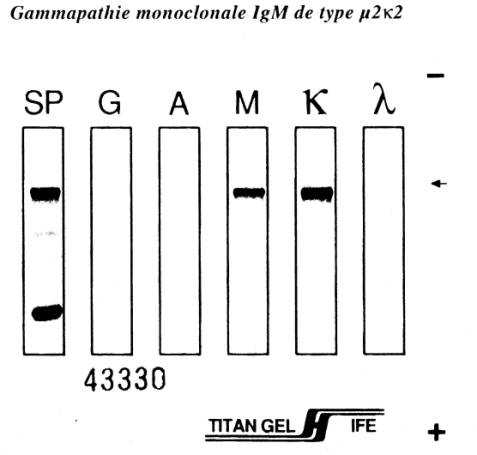
Figure : M Marien
III - Maladies des chaînes lourdes
Les maladies des chaînes lourdes sont caractérisées par la présence dans le séum d'une immunoglobuline monoclonale incomplète, réduite à un fragment de chaîne lourde g, m ou a et dépourvue de chaîne légère. Le diagnostic est fait par immuno-électrophorèse et immuno-fixation.
A - Maladie
des chaînes lourdes g
Dans la maladie des chaînes lourdes g, qui affecte souvent les hommes dans la deuxième partie de leur vie, on observe une adénomégalie généralisée avec hépato-splénomégalie, associée parfois à érythème palatin et un oedème de la luette.
B - Maladie
des chaînes a
Elle atteint des sujets jeunes du pourtour méditerranéen et d' Amérique latine. La forme digestive est la plus fréquente, se traduisant par un syndrome de malabsorption intestinale grave avec atrophie villositaire et prolifération lymphoplasmocytaire initialement bénigne infiltrant la totalité de l'intestion grêle et les ganglions mésentériques. Cette distribution géographique indique le rôle possible d' agents infectieux dans la pathogénie de la maladie qui peut évoluer vers une prolifération lymphoïde maligne.
C - La
maladie des chaînes m
La symptomatologie est identique à celle de la LLC et de la macroglobulinémie de Waldenström.
IV - Méthodologies
A -
Immunodiffusion double: méthode d'Ouchterlony
Des puits sont creusés à l'emporte-pièce dans une couche de gélose peu épaisse, à une distance prédéterminée les uns des autres, dépendant du coefficient de diffusion respectif des réactifs. Les solutions d'antigène et d'anticorps sont déposées l'une en face de l'autre. Le délai d'apparition des arcs de précipitation peut être long (deux jours à une semaine).
Cette méthode qualitative, quoique peu sensible, permet d'analyser des sytèmes antigène-anticorps grâce à des <<réactions d'identité>> : pour comparer deux antigènes ou pour détecter la présence de plusieurs anticorps dans un sérum, on peut disposer deux puits d'antigène en face du puits contenant le sérum. Plusieurs aspects de précipitation peuvent alors être observés:
1. Réaction d'identité: si les deux antigènes sont identiques ou ont des épitopes semblables, leurs lignes de précipitation avec l'anticorps seront en continuité.
2. Réaction de non-identité: si les deux antigènes sont différents et donc se combinent à deux anticorps, les arcs de précipitation se croiseront.
3. Réaction d'identité particielle: si les deux antigènes comportent un ou plusieurs antigènes en commun, tout en ne différant pas d'autres épitopes, on observera un arc de précipitation continu et un arc supplémentaire en forme d'éperon qui vient se brancher sur l'arc continu.
B - Dosage
des immunoglobulines par Immunodiffusion radiale: méthode de Mancini
Cette technique est employée pour des dosages semi-quantitatifs d'antigènes. L'anticorps spécifique est incorporé à la gélose de façon homogène avant sa solidification et son étalement sur une plaque.
Des puits sont ensuite creusés, où l'antigène est déposé, éventuellement à des dilutions différentes. La diffusion et la rencontre de l'antigène avec l'anticorps autour des puits détermineront des anneaux, ou plutôt des cercles de précipitation dont la surface (ou le carré du diamètre) est proportionnelle à la concentration d'antigène. en incorporant à la gélose un anticorps spécifique d'un isotype d'immunoglobuline et en déposant dans un puits le sérum à tester, on peut ainsi doser l'immunoglobuline sérique correspondant à l'anticorps dans la gélose.
Le dosage est fait par comparaison avec une courbe étalon établie avec des concentrations connues d'antigène.
C -
Immunoélectrophorèse: méthode de Grabar et Williams:
Lorsque l'on veut étudier plusieurs antigènes au sein d'une solution complexe comme un sérum, la double diffusion ne suffit plus à identifier tous les traits de précipitation. L'immunoélectrophorèse pallie cet inconvénient en séparant au préalable les antigènes selon leur mobilité électrophorétique. Dans un deuxième temps, une réaction de précipitation est réalisée à l'aide d'anticorps spécifiques qui réagissent avec chacun des antigènes.
Pratiquement on réalise d'abord dans la gélose une électrophorèse de la solution antigénique à étudier. On dispose ensuite dans une gouttière creusée dans la gélose parallèlement au sens de migration électropborétique des antigènes, la solution d'anticorps spécifiques. Les antigènes et les anticorps migrent les uns vers les autres, se rencontrent et précipitent selon des arcs disposés le long de la gouttière.
Cette technique est notamment utilisée pour l'analyse des protéines du sérum humain: elle nécessite l'emploi d'anti-sérums animaux spécifiques des protéines du sérum humain. Près de 30 protéines du sérum sont révélées chacune par un arc de précipitation. En pratique, pour le diagnostic d'une Ig monoclonale, on utilise des anticorps monospécifiques des chaînes lourdes gamma, alpha et mu et des chaînes légères kappa et lamda. La même technique permet de faire l'analyse des protéines urinaires ou du liquide céphalorachidien. Ce même test peut être réalisé dans les urines pour la détection des chaînes légères (protéinurie de Bence Jones). On peut aussi déceler les divers anticorps spécifiques de certains parasites en mettant dans la gouttière la solution antigénique.
L'immuno-électrophotèse est une méthode qualitative. Elle permet seulement d'apprécier une précipitation (l'épaisseur et la forme d'un arc) ou son absence par rapport à un témoin. L'immuno-électrophorèse est la méthode de choix pour caractériser une immmunoglobuline monoclonale (dans le sérum et les urines concentrées). Une immunoglobuline monoclonale donne un arc de précipitation plus épais, incurvé et proche de la gouttière, qui se continue avec l'arc (souvent diminué) des immunoglobulines de la même classe.
D -
Electrosynérèse ou contre-immunoélectrophorèse:
Elle dérive de l'immunodiffusion double d'Ouchterlony. Un courant électrique accélère la dffusion de l'antigène et de l'anticorps l'un vers l'autre. Le pH du tampon de la gélose est choisi pour que l'antigène migre vers l'anode et l'anticorps vers la cathode.
Cette technique est plus sensible que celle d'Ouchterlony. Elle est cependant plus délicate à réaliser. La migration doit être suivie d'un lavage prolongé de la plaque pour éliminer les faux arcs de précipitation, puis d'un séchage et d'une coloration par le bleu de Coomassie ou le noir amidon afin de visualiser certains arcs très fins. Des réactions d'identité peuvent être effectuées comme par la technique d'Ouchterlony, en disposant les puits en quinconce.
L'électrosynérèse est utilisée, par exemple, pour la détection des anticorps spécifiques des antigènes nucléaires solubles.
E -
Immunofixation:
Dans un premier temps, les constituants d'un mélange complexe, comme le sérum, sont séparés par électrophorèse en agar. Dans un deuxième temps, les différentes molécules que l'on souhaite étudier sont révélées sélectivement par une réaction avec un anticorps spécifique déposé à la surface du gel. Cet anticorps pénètre rapidement dans le gel et se combine in situ l'antigène correspondant. Les molécules non reconnues par cet anticorps sont éliminées par lavage. Les complexes Ag-Ac qui restent peuvent être facilement colorés, donnant ainsi une image exacte de la répartition des molécules d'antigènes après l'électrophorèse.
Cette
technique est beaucoup plus rapide, mais surtout beaucoup plus sensible que
l'immunoélectrophorèse pour faire le diagnostic de la monoclonalité des
immunoglobulines. Elle tire son avantage du fait que l'antigène n'a pratiquement
pas le temps de diffuser avant de réagir avec l'anticorps comme c'est le cas
dans l'immuno-électrophorèse. Enfin l'interprétation des profils obtenus par
cette technique est souvent plus facile que par immunoélectrophorèse.
DIAGNOSTIC D'UNE CRYOGLOBULINEMIE
I - Contexte clinique
Les signes cliniques les plus fréquemment révélateurs d'une cryoglobulinémie sont cutanés:
purpura pétéchial et ecchymotique, syndrome de Raynaud, érythrocyanose voire nécrose des extrémités. Ces manifestations sont généralement déclenchées ou exacerbées par le froid.
Une cryoglobulinéme peut aussi se révéler par des arthralgies migratrices, généralement sans arthrite, et plus rarement par une neuropathie périphérique à type de multinévrite.
Les cryoglobulinémies peuvent être associées:
- à des syndromes lympho-prolifératifs (myélome, macroglobulinémie de Waldenström, leucémie lymphoïde chronique, autres lymphomes B)
- à des connectivites (syndrome de Gougerot-Sjögren, polyarthrite rhumatoïde, lupus érythémateux disséminé, périartérite noueuse)
- à des infections virales (hépatites B et C ).
II - Diagnostic biologique
Une cryoglobuline est une immunoglobuline qui précipite au froid, mais la température de précipitation est variable, parfois pas très éloignée de 37° C. Le diagnostic repose sur la mise en évidence de molécules d'immunoglobulines au sein d'un précipité apparu dans un sérum conservé au froid.
Les conditions de prélèvement sont d'une importance extrême pour la fiabilité du test:
Immédiatement après le prélèvement, le sang doit être mis à 37° C et maintenu à cette température pendant le transport jusqu'au laboratoire, et pendant la séparation du sérum des cellules sanguines.
Si la cryoglobuline est en faible quantité dans le sérum, sa précipitation peut nécessiter une conservation prolongée (jusqu'à une semaine) à + 4° C.
Lorsque la précipitation est douteuse (cryoglobuline en très faible concentration) elle peut être vérifiée par turbidimétrie. Les sérums positifs sont centrifugés. Les cryoprécipités sont lavés plusieurs fois et redissous à 37° C. Les cryoglobulines sont ensuite caractérisées par immunodiffusion (Ouchterlony) et immuno-électrophorèse ou immuno-fixation réalisées à 37° C.
III - Classification
Le type I représente 10 à 40 % des cas. La cryoglobulimine est monoclonale (IgM, IgG, IgA, chaîne légère k, chaîne légère l par ordre de fréquence décroissante) et est le plus souvent associée à un syndrome lymphoprolifératif.
Le type II représente 15 à 70 % des cas. Il est constitué de deux types d'immuglobulines: une monoclonale et des molécules polyclonales. La cryoglobuline mixte de type II est donc un ensemble de complexes macromoléculaires où une IgM monoclonale est le plus souvent combinée à des IgG polyclonales: il s'agit d'un facteur rhumatoïde monoclonal. Les cryoglobulines de type II sont asociées à des syndromes lymphoprolifératifs, au syndrome de Gougerot-Sjögren ou à des infections virales.
Le type III est constitué uniquement d'immunoglobulines polyclonales. Il s'agit donc de facteurs rhumatoïdes polyclonaux. Les cryoglobulines de type III sont plus souvent associées à des infections virales ou a des connectivites. On peut détecter au sein du cryoprécipité des Ag viraux (omme le virus B de l'hépatite) orientant le diagnostic vers une périartérite noueuse, ou de l'ADN suggérant plutôt un lupus érythémateux disséminé. Certaines cryoglobulinémies "idiopathiques" restent isolées.
Il arrive donc fréquemment de détecter des facteurs rhumatoïdes dans le sérum de patients porteurs d'une cryoglobuline de type II ou III, sans qu'ils soient atteints pour autant de polyarthrite rhumatoïde.