![]()

Chapitre 16
INTRODUCTION AUX ETATS
D'HYPERSENSIBILITE
Selon
la classification de Gell & Coombs, on distingue quatre types
d'hypersensibilité (HS) :
1° l'hypersensibilité du type I (ou allergie immédiate) : elle
survient chez des sujets prédisposés par un terrain, dit atopique, et est liée
à la production excessive d'IgE spécifiques d'allergènes divers, le plus
souvent inhalés ou ingérés. Les symptômes qui peuvent alors apparaître sont
respiratoires (rhinite, toux spasmodique et asthme), oculaires (conjonctivite
le plus souvent), digestifs (vômissements, douleurs abdominales, diarrhée), ou
cutanés (dermatite atopique, urticaire et/ou oedème de Quincke). On estime que,
dans les pays occidentaux, 15 à 20 % des individus sont atteints d'allergie
immédiate. L'anaphylaxie se rapproche de l'allergie
immédiate, dans la mesure où elle est également liée à des IgE. Toutefois, elle
s'en distingue par le fait qu'elle peut survenir aussi bien chez des sujets
atopiques que non atopiques, et que les allergènes en cause sont généralement
différents de ceux de l'allergie immédiate : il s'agit essentiellement des
médicaments, de certains aliments et des venins d'hyménoptères.
2°
l'hypersensibilité cytotoxique (HS du type II) : elle est liée à des
anticorps (IgM, IgG) qui se fixent sur des antigènes exprimés constitutivement
ou adsorbés passivement sur la membrane des cellules de l'organisme. Ces
anticorps induisent la destruction des cellules en activant le système du
complément et/ou par opsonisation des cellules phagocytaires-cytotoxiques
(monocytes et macrophages, lymphocytes K ou tueurs).
Les
manifestations liées à ce type d'HS ne sont qu'exceptionnellement du ressort de
l'allergologue : il s'agit essentiellement de cytopénies (anémies hémolytiques,
thrombopénies, leucopénies), et de certaines néphrites intersticielles et
tubulo-intersticielles induites par des médicaments.
L'hypersensibilité
cytotoxique intervient également dans certaines maladies auto-immunes, telles
le syndrome de Goodpasture, le pemphigus et la pemphigoïde bulleuse, etc.
3°
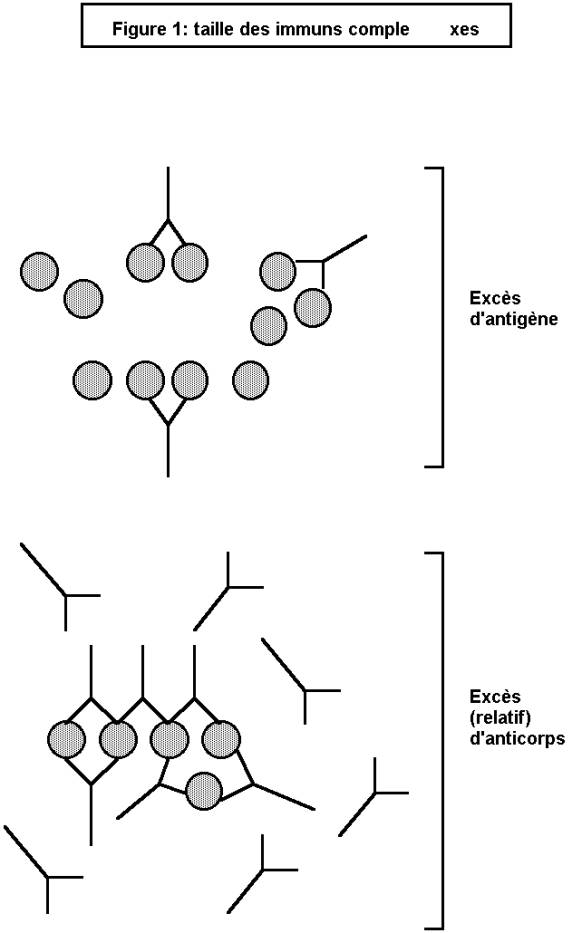
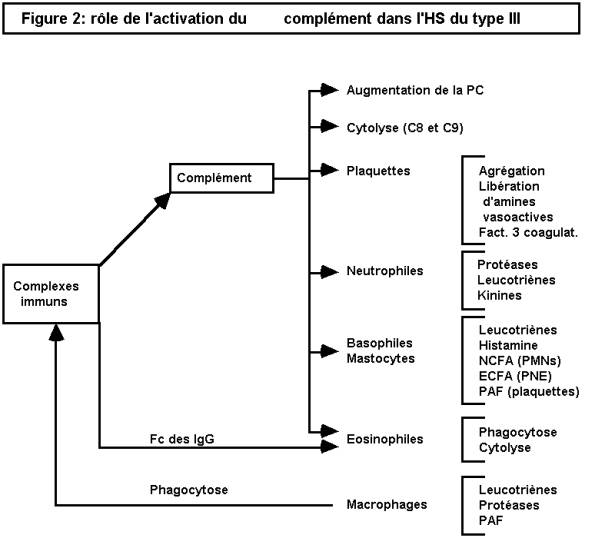
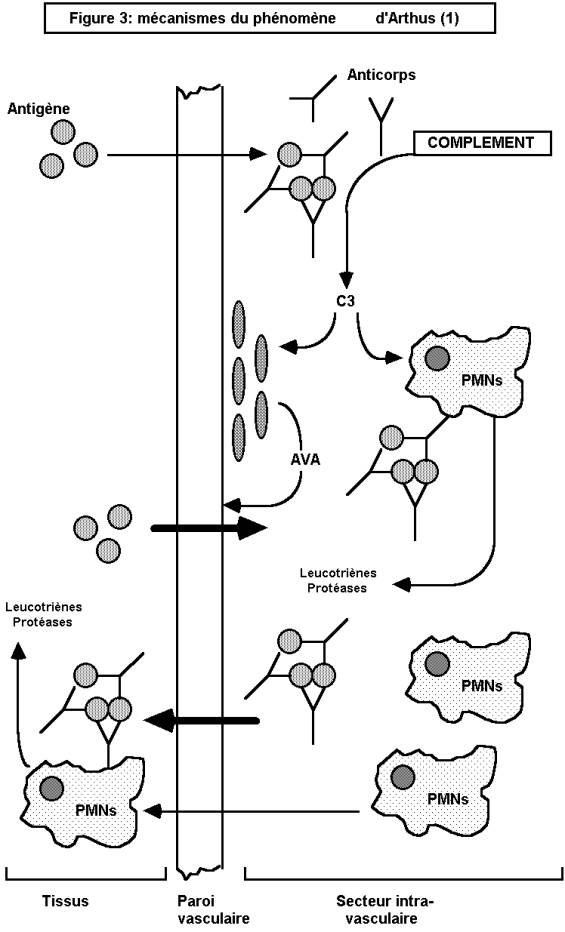
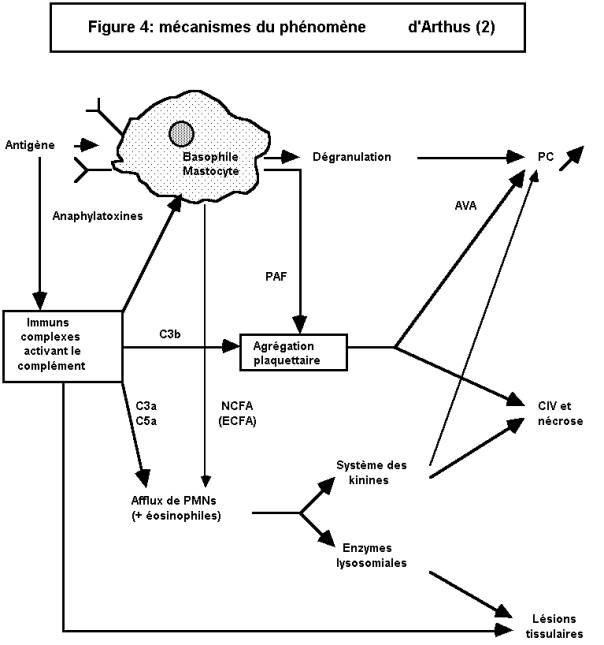
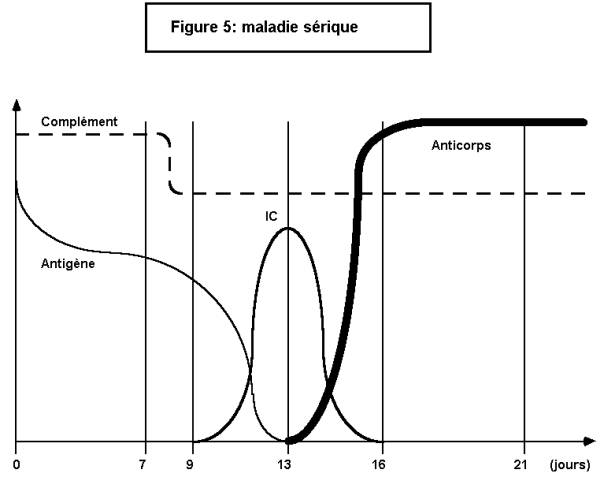
l'hypersensibilité semi-retardée (ou HS du type III) : elle est liée à
la formation et au dépôt de complexes antigène-anticorps (com-plexes immuns :
CI) dans les tissus. On distingue le phénomène d'Arthus, où les CI se
constituent au niveau même des tissus, et la maladie sérique, où ils se forment
dans la circulation, avant de se déposer dans les tissus.
Les
principales affections allergologiques relevant d'une HS de type III sont les
pneumopathies d'hypersensibilité, soit liées à l'inhalation répétée d'antigènes
organiques (maladies des poumons de fermier, des éleveurs d'oiseaux et des
colombophiles, etc.), soit induites par des médicaments ingérés ou injectés.
Certaines
néphropathies, vascularites et éruptions cutanées, essentiellement dûes à des
médicaments, relèvent aussi d'une HS semi-retardée du type maladie sérique.
Les
CI circulants jouent aussi un rôle important dans la pathogénie des maladies
auto-immunes non organospécifiques (diffuses), tel-les le lupus érythémateux
disséminé (LED), l'arthrite rhumatoïde (AR), etc.
4°
l'hypersensibilité retardée (HSR ou HS du type IV) : elle résulte du
recrutement et de l'activation, au niveau même des organes et des
tissus-cibles, de cellules effectrices diverses (monocytes et macrophages ;
lymphocytes T effecteurs et cytotoxiques ; cellules de Langerhans, dans la
peau), sous l'effet de substances (cytokines) secrétées par les lymphocytes T
activés par l'antigène.
Les
principales affections allergologiques relevant d'une HSR sont les eczémas de
contact ou par ingestion, et certaines photodermato-ses ; d'autres
affections (urticaires chroniques, "allergies" microbiennes)
pourraient égale-ment relever, au moins en partie, d'une HSR.
L'HSR
joue également un rôle important dans certaines maladies auto-immunes
spécifiques d'organes, dans les mécanismes de défense anti-infectieuse (défense
contre les micro-organismes à développement intra-cellulaire, tels les virus,
les mycobactéries, et certains parasites), et dans les processus de défense
antitumorale.
Hypersensibilité de type I
(allergie immédiate & anaphylaxie)
I - Physiopathologie de l'allergie immédiate et des réactions
anaphylactiques et anaphylactoïdes
A - Introduction
1)
Définitions
Le terme allergie définit, d'une façon large, un ensemble
de manifestations cliniques liées à une réponse anormale de l'organisme à
l'introduction de substance(s) non toxique(s), faisant intervenir une réponse
immunitaire excessive et/ou inadaptée spécifique de la (des) substance(s) en
cause, et ne survenant que chez un nombre limité d'individus (synonyme =
réaction d'hypersensibilité).
Selon
la classification de Gell & Coombs, l'allergie immédiate (HSI) caractérise
l'ensemble des manifestations cliniques survenant chez des individus
génétiquement prédisposés par un terrain dit atopique, ce terrain étant
caractérisé par une production exagérée d'IgE, en réponse aux stimulations
exercées par les antigènes de l'environnement, également appelés allergènes ; ces
sujets présentent également une réactivité exagérée des organes et des tissus
cibles (muqueuse nasale, bronches, peau, etc.) aux stimulations exercées par
les allergènes et par les facteurs non spécifiques de l'environnement
(irritants de la peau et des voies respiratoires, inhalation d'air froid et
sec, exercice physique, etc.).
2) Génétique de l'atopie
Le caractère génétique de l'atopie a initialement été mis
en évidence par les études de familles. Ainsi, les études de la transmission
des parents aux enfants montrent que, pour un enfant, le risque d'être atopique
est respectivement de l'ordre de 15 %, 25 à 30 %, et 50 à 60 % lorsque
aucun, un seul ou les deux parents sont allergiques ; ce risque peut même
atteindre 80 % lorsque les deux parents sont atteints de la même maladie
allergique (rhinite et/ou asthme, notamment).
Les
études des fratries nées de parent(s) atopique(s) montrent une
concordance de l'ordre de 40 % entre enfants non jumeaux ou jumeaux
dizygotes, de 70 à 90 % entre jumeaux monozygotes élevés ensemble, et de
45 à 65 % entre jumeaux monozygotes élevés séparément : compte-tenu du fait que
la prévalence de l'atopie est comprise entre 12,5 et 20 % dans la population
générale, ces résultats montrent bien l'existence de facteurs génétiques
transmis des parents aux enfants. Toutefois, la différence entre les jumeaux
monozygotes qui ont été élevés ensemble et ceux qui ont été élevés séparément
montre aussi le rôle joué par l'environnement (exposition aux allergènes notamment)
dans le développement des maladies allergiques.
Les
études génomiques et chromosomiques ont permis de mettre en évidence des
associations entre allergie immédiate et certains gènes particuliers (études
génomiques) ou des marqueurs retrouvés avec une fréquence anormalement élevée
sur certains chromosomes des individus atopiques (études chromosomiques) ;
ces marqueurs correspondent à des groupes de gènes (dits gènes candidats),
codant pour des cytokines, des systèmes enzymatiques ou des récepteurs impliqués
dans la physiopathologie des maladies allergiques (cf. Tableau I).
B – Les acteurs de l’HS immédiate
1)
Les anticorps (IgE)
Les travaux d'Ishizaka ont permis de montrer que
l'activité du sérum des allergiques était liée à une classe d'immunoglobulines
distincte des autres classes connues et de concentration sérique extrêmement
faible. Cette classe d'anticorps fut isolée en 1966, et reçut le nom d'IgE
(erythema-wheal reaction-inducing immunoglobulin). A la même époque, Bennich
& Johansson isolaient une protéine myélomateuse qui, après étude
comparative, se révéla être identique aux IgE. Il fut ensuite démontré que les
IgE pouvaient se fixer sur la membrane des basophiles et des mastocytes, et que
l'adjonction d'antiglobulines (anti-IgE) induisait une activation des cellules
ainsi sensibilisées par des IgE, se traduisant notamment par une dégranulation
et une libération d'histamine dans le surnageant.
Origine, structure et propriétés générales des IgE : les IgE sont des anticorps synthétisés et excrétés par les lymphocytes B et les plasmocytes à IgE. Comme toutes les immunoglobulines, les IgE sont constituées de l'assemblage de deux chaînes lourdes (chaînes e) et de deux chaînes légères du même type (k ou l) (Fig. 1) ; il n'existe pas de sous-classes connues pour les IgE. Les IgE ne traversent pas le placenta et n'activent pas le complément, tout du moins par la voie classique.
On
trouve des IgE dans le serum, ainsi que dans certaines sécrétions (salive,
sécrétions nasales, urines, selles). Le taux des IgE sériques est presque nul à
la naissance, et croît progressivement de 10 à 15 UI/ml par année
d'âge (une unité internationale correspondant à 2,4 ng) pour atteindre le taux
adulte (< 200 à 250 UI/ml) vers l'âge de 10-12 ans. L'origine
des IgE sécrétoires est double : une certaine proportion de ces anticorps
provient d'une synthèse locale par les lymphocytes B et les plasmocytes à IgE
des muqueuses, le reste provenant d'une simple transsudation des IgE sériques.
Les
IgE sont capables de se fixer sur la membrane de certaines cellules, cette
fixation prolongeant leur demi-vie, qui peut alors dépasser 3 à 4 semaines, et
leur permettant d’exercer leurs fonctions. Plusieurs types de récepteurs ont
été identifiés :
- des récepteurs de type I (Fce-RI, de forte affinité), qui sont exprimés sur la membrane des cellules effectrices de l'allergie immédiate (mastocytes et basophiles, mais aussi éosinophiles, monocytes et macrophages, etc.) ;
- des récepteurs de type II (Fce-RII, ou antigène CD23), de faible affinité et exprimés sur des cellules diverses, et notamment sur les lymphocytes T (Te) et B (Be) régulant la production des IgE. L'expression des Fce-RII est modulée par certaines cytokines (IL-4 stimulante, et IFN-g inhibiteur), ainsi que par le taux des IgE elles-mêmes ; enfin, ces récepteurs peuvent être libérés sous forme soluble (sCD23), et les interactions entre le CD23 (de membrane ou soluble) et les lymphocytes B à IgE contribuent activement à stimuler la production des IgE par ces cellules (cf. infra) ;
- enfin, des récepteurs de type III (e-BP ou galectine/Mac-2), également de faible affinité, exprimés sur des types cellulaires très divers, et dont les fonctions sont encore mal connues.
Régulation de la synthèse des IgE : les mécanismes régulant la
synthèse des IgE ont tout d'abord été étudiés chez l'animal (souris et rat,
notamment), les résultats obtenus chez ces animaux ayant permis d'orienter les
études effectuées ultérieurement chez l'homme. Les travaux effectués chez
l'animal ont permis de montrer que :
- les
réponses IgE étaient particulièrement dépendantes du thymus et des lymphocytes
T ;
- la
synthèse des IgE était régulée par des mécanismes contrôlant sélectivement la
production des IgE, sans modifier celle des anticorps des autres classes
(notion de régulation isotypique) ;
- les lymphocytes contrôlant la synthèse des IgE exprimaient des récepteurs de membrane pour les IgE (lymphocytes Te et Be) et, selon leurs conditions d'activation, produisaient des facteurs stimulant (IgE-PF ou IgE synthesis-potentiating factor) ou inhibant (IgE-SF ou IgE synthesis-suppressor factor) la production des IgE.
Chez l'homme, les principales cellules régulant la synthèse des IgE sont les lymphocytes Be (CD23+) : activées par les IgE et les complexes immuns à IgE, et surtout par certaines cytokines (interleukines 4 et 10 : cf. infra), ces cellules libèrent le fragment extracellulaire de leurs récepteurs de membrane pour les IgE sous la forme de sCD23, qui stimule la production des IgE par les lymphocytes B activés. L'expression du CD23 et sa libération sont également stimulées par des médiateurs de l'allergie, tels le PAF (platelet-activating factor) et le LTB4 (leucotriène B4). Ont également été identifiés des lymphocytes T (Te) et des monocytes sanguins exprimant des récepteurs de faible affinité pour les IgE ; il est probable que ces cellules exercent aussi des effets modulateurs sur la production des IgE, mais ceci n'a pas encore été établi avec certitude.
D'autres mécanismes, dont les interactions avec les systèmes décrits ci-dessus commencent à bien être connues, exercent également des effets régulateurs déterminants sur la production des IgE, chez l'homme et chez les rongeurs : l'interleukine 4 (IL-4), ainsi que les IL-10 et 13, toutes trois produites par les lymphocytes T helper de type 2 (Th2), stimulent la génération et l'activation des LyTh2 eux-mêmes et des LyBe, la libération du sCD23, la différenciation des lymphocytes B en plasmocytes producteurs d'IgE et, par voie de conséquence, la production des IgE. Ces effets sont inhibés par l'IFN-g (interféron-gamma) et l'IL-2 (produits par les LyTh1), ainsi que par l'IL-12 (produite par les cellules présentatrices d'antigène et orientant les réponses immunitaires vers des réponses du type Th1). L'IFN-g inhibe également la production d'IL-4, d'IL-10 et d'IL-13 par les lymphocytes Th2, alors que les IL-4, 10 et 13 inhibent la production d'IFN-g par les lymphocytes Th1 (Fig. 2).
2)
Cellules effectrices et médiateurs
Classiquement, les principales cellules qui produisent les
médiateurs de l'allergie immédiate sont les polynucléaires basophiles et les
mastocytes, dont les principales caractéristiques sont indiquées dans le
tableau II. Cependant, les résultats des études effectuées dans le courant de
ces dernières années ont montré que d'autres cellules (polynucléaires
neutrophiles et éosinophiles, monocytes et macrophages, plaquettes, cellules
endothéliales, cellules des épithéliums muqueux, et lymphocytes T) jouaient
également un rôle important dans la pathogénie de ces réactions.
Les mastocytes : il s'agit de cellules dont les précurseurs médullaires sont
probablement communs aux cellules de la lignée monomacrophagique. Ces
précurseurs peuvent également être détectés dans le sang circulant, les organes
lymphoïdes centraux et périphériques, et certains organes et tissus non
lymphoïdes (peau, tractus digestif, etc....). C'est au niveau de ces organes
que s'effectue leur maturation en mastocytes.
Dans
l'espèce humaine, on distingue deux principaux types de mastocytes :
- les
mastocytes T, dont les granulations contiennent essentiellement de la tryptase
: ils représentent le type de mastocytes prédominant dans les muqueuses, et
envi-ron un tiers des mastocytes pulmonaires. Leur nombre est significativement
augmenté dans la muqueuse nasale des malades atteints de rhinite allergique et
dans la paroi et les sécrétions bronchiques des asthmatiques ;
- les
mastocytes TC, dont les granulations contiennent de la tryptase et de la
chymase : ils représentent le type de mastocytes prédominant dans la peau
(derme) et les sous-muqueuses, et environ les deux tiers des mastocytes
pulmonaires.
En
sus des médiateurs classiques de l'inflammation et de l'allergie (histamine,
prostaglandines et leucotriènes, PAF, etc.....), les mastocytes activés
produisent des cytokines diverses comme l'IL-1, l'IL-3, le GM-CSF
(granulocyte/macrophage colony-stimulating factor), l'IL-4, l'IL-5, et le TNF
(tumor necrosis factor, pro-inflammatoire) ; la participation de ces cytokines
aux réactions allergiques du type immédiat est discutée plus loin.
Les basophiles : il s'agit de cellules de la lignée granulocytaire, qui
dérivent de précurseurs localisés dans la moelle osseuse. Bien qu'ils puissent
se localiser dans les tissus, dans certaines circonstances pathologiques (phase
de début des dermites de contact, urticaires chroniques et phase tardive des
réactions allergiques du type immédiat, notamment), les basophiles sont
essentiellement des cellules du sang circulant. Leurs granulations
intracytoplasmiques contiennent les médiateurs préformés qui seront expulsés
lors de l'activation des basophiles : histamine, ECFA (eosinophil chemotactic
factor of anaphylaxis) et NCFA (neutrophil factor of anaphylaxis), notamment ;
elles contiennent également une certaine quantité de MBP (major basic protein),
comme celles des polynucléaires éosinophiles.
Chez
les allergiques, il existe une augmentation significative du nombre et du
pourcentage des basophiles sanguins, notamment pendant les expositionx aux
allergènes ; en outre les basophiles des allergiques sont particulièrement
activables par les allergènes, l'anti-IgE, certaines cytokines, et les
activateurs non spécifiques.
Les autres cellules effectrices de l'allergie immédiate : de nombreuses autres cellules
participent à des degrés divers à la pathogénie des réactions allergiques du
type immédiat. Certaines d'entre elles (un certain pourcentage des macrophages,
cellules de Langerhans, polynucléaires éosinophiles, plaquettes), qui possèdent
des récepteurs membranaires pour les IgE, et qui peuvent être sensibilisées in
vivo par les IgE, seraient directement activées par la fixation de l'antigène
sur les IgE elles-mêmes fixées sur leur membrane. Cependant, d'une façon
générale, le recrutement et l'activation de ces cellules (cellules effectrices
dites "secondaires") n'interviennent que dans un second temps (phase
tardive de la réaction d'allergie immédiate), et résultent essen-tiellement des
effets chimiotactiques et (pré)activateurs des médiateurs et cytokines libérés
par les mastocytes.
Les
polynucléaires éosinophiles (PNE) sont les principales cellules effectrices
secondaires de l'allergie immédiate chez l'homme : leur prolifération et leur
survie sont essentiellement assurées par l'IL-5, comme le confirment les
résultats d'une étude récente qui montre que, chez les souris transgéniques
fortement productrices d'IL-5, il existe une importante éosinophilie sanguine
et tissulaire qui, pour l'essentiel, est inhibée par les anticorps anti-IL-5.
Le recrutement local des éosinophiles est favorisé par d'autres cytokines qui
exercent des effets chimiotactiques (IL-3 et 6, GM-CSF), et qui stimulent
l'expression de molécules d'adhésion intercellulaire sur les cellules
endothéliales (IL-4).
Les
PNE contiennent de nombreuses enzymes, qui sont libérées dans le
micro-environnement et le sang, après que les éosinophiles aient été activés :
il s'agit notamment de la MBP (major basic protein), de l'ECP (eosinophil
cationic protein), de l'EPO (eosinophil peroxydase) et de l'EDN
(eosinophil-derived neuro-toxin). Toutes ces enzymes exercent, à des degrés
divers, des effets cytotoxiques (lésions des épithéliums cutané et muqueux, et
des cils vibratiles), pro-inflammatoires (chimiotactisme et activation des
mastocytes, des basophiles, et des autres cellules effectrices), et
neurotoxiques (activation des terminai-sons nerveuses parasympathiques, à
l'origine du prurit et de l'hyperréactivité nasale ou bronchique).
Les
PNE activés libèrent également :
- des
médiateurs divers : PAF, leucotriènes (LTC4 et LTD4 principalement), et
prostaglandines ;
- des
anions peroxyde (O2-) et superoxyde (H2O2), cytotoxiques pour des cellules
diverses, et qui induisent une dégranulation non spécifique des mastocytes ;
- des
neuropeptides pro-inflammatoires, histaminolibérateurs et bronchoconstricteurs
(substance P notamment).
De
nombreuses observations montrent que les PNE jouent un rôle important dans la
pathogénie des réactions allergiques du type immédiat (asthme et
rhinites/sinusites notamment). Ainsi :
- leur
nombre est significativement augmenté dans le sang, le chorion de la muqueuse
respiratoire, et les sécrétions nasales et bronchiques des allergiques ;
- chez
les allergiques, une forte proportion des éosinophiles sont
"hypodenses". Il s'agit de PNE activés, qui expriment de très
nombreux récepteurs pour les IgE, des molécules d'adhésion intercellulaire, et,
semble-t-il, des antigènes d'histocompatibilité de classe II ;
- des
taux élevés des médiateurs produits par les PNE sont détectés dans le sang et
dans les sécrétions respiratoires (ECP et MBP notamment) ;
- il
existe une corrélation entre l'hyperréactivité bronchique ou nasale et les
concentrations de la MBP et des PNE dans le liquide de lavage bronchoalvéolaire
(LBA) ou de lavage nasal, chez les sujets atteints d'asthme ou de rhinite ;
- enfin,
il existe une corrélation entre la production in vitro de LTC4 par les PNE et
la sévérité des symptômes, ainsi que le degré d'hyperréactivité bronchique,
chez les asthmatiques.
Les
cellules monomacrophagiques : divers arguments permettent fortement de suggérer
qu’elles jouent un rôle important dans la physiopathologie des réactions
allergiques, et notamment de l'asthme. En effet :
- in
vivo, d'importantes quantités de macrophages sont présents à la surface de
l'épithélium bronchique et dans le liquide de LBA des asthmatiques. De plus,
une importante proportion des macrophages pulmonaires des asthmatiques expriment
des récepteurs pour les IgE, et, ex vivo, sont activables par les stimulations
IgE-dépendantes ;
- il
existe des signes d'activation des macrophages alvéolaires chez les
asthmatiques (mis en évidence par une augmentation de la chemiluminescence), dont
l'intensité est significativement corrélée avec la gravité de l'asthme ;
- enfin, ex vivo, les macrophages libèrent des médiateurs directement ou indirectement impliqués dans les réactions allergiques, tels le PAF, le TXB2 (thromboxane B2), et le LTB4 ; ils libèrent également diverses cytokines histaminolibératrices et pro-inflammatoires (IL-1 et 6, TNF-a), la production de ces médiateurs et cytokines étant significativement plus importante chez les allergiques que chez les non aller-giques.
Les
macrophages (alvéolaires) activés produisent également un antagoniste du
récepteur pour l'IL-1 (IL-1Ra : IL-1 Receptor-antagonist) et un inhibiteur du
TNF (TNF-Inh), qui pourraient contribuer, dans une certaine mesure, à modérer
les réactions allergiques ; toutefois, la production de ces inhibiteurs est
significativement plus faible chez les allergiques que chez les témoins non
allergiques.
Les
lymphocytes T jouent un rôle déterminant dans la pathogénie des réactions
allergiques du type immédiat : en effet, on observe couramment un infiltrat
riche en lymphocytes T (essentiellement CD4+) durant la phase tardive de ces
réactions, ainsi qu'une augmentation de la proportion des lymphocytes T activés
(exprimant des antigènes d'histocompatibilité de classe II et des récepteurs
membranaires pour l'IL-2) dans le sang et la muqueuse bronchique des sujets
atteints d'asthme sévère. Chez les asthmatiques, l'importance de l'infiltrat en
lymphocytes T activés est significativement corrélée avec l'augmentation du
nombre des éosinophiles dans le liquide de LBA et avec la sévérité de l'asthme.
Les résultats de plusieurs études récentes ont montré que la majorité des
clones de lymphocytes T CD4+ isolés du site des réactions allergiques étaient
des lymphocytes Th2, et qu'une certaine proportion d'entre eux exprimaient des
récepteurs de faible affinité pour les IgE (CD23+). Par ailleurs, les
lymphocytes T sanguins des sujets allergiques sont hyperactivables in vitro,
alors que ceux des non-atopiques le sont peu.
Bien
que persistent encore certaines incertitudes, on peut penser que les
lymphocytes T participent à la phase effectrice des réactions allergiques du
type immédiat en produisant divers facteurs et médiateurs :
- des
cytokines exerçant des effets mitogéniques et/ou chimiotactiques sur les
polynucléaires basophiles et les mastocytes (IL-3, GM-CSF), ainsi que sur les
éosinophiles (IL-5, GM-CSF). Il existe d'ailleurs une corrélation significative
entre le degré d'éosinophilie sanguine et le pourcentage des lymphocytes T
activés dans le sang des sujets allergiques ;
- des
facteurs exerçant des effets histaminolibéra-teurs non spécifiques ou
potentialisant la dégranulation IgE-dépendante des basophiles et des
mastocytes, comme les IL-2, 3 et 5.
Le
rôle-clé joué par les lymphocytes T dans la phase tardive de la réaction
allergique du type immédiat vient d’être mis en évidence par des expériences
montrant que le transfert passif de lymphocytes T spécifiques à des rats non
immunisés leur transfère la capacité de développer une réponse tardive aux
stimulations allergéniques, alors que la réactivité immédiate est conférée par
le transfert passif de sérum riche en IgE spécifiques.
Les
cellules épithéliales : il est maintenant clairement établi que ces
cellules (notamment dans les épitheliums respiratoire et conjonctival)
expriment des molécules d'adhésion intercellulaire, au cours des réactions
allergiques ou des tests de provocation spécifiques, et sont capables de
produire des médiateurs chimiotactiques et activateurs pour les polynucléaires
éosinophiles et pour les cellules mono-macrophagiques (LTB4 et LTC4), ainsi que
des substances stimulant la production du mucus bronchique ; enfin, elles
produisent des cytokines diverses, telles le GM-CSF, l'IL-6 et l'IL-8. A ce
titre, les cellules épithéliales pourraient bien jouer le rôle de cellules
effectrices de l'allergie immédiate.
Toutefois,
les cellules épithéliales semblent également jouer physiologiquement un certain
rôle protecteur, notamment en réduisant la pénétration des allergènes, en
"protégeant" les terminaisons nerveuses sensorielles de l'arbre
respiratoire, et en produisant un/des facteur(s) bronchorelaxant(s) dont la
nature n'est pas encore clairement établie. Elles produisent également de
l'enképhalinase ou NEP (neutral endopeptidase), qui inactive les neuropeptides
bronchoconstricteurs. La réduction de ces propriétés protectrices, liée à
l'abrasion des cellules de l'épithélium bronchique, est probablement l'un des
facteurs déterminants de l'hyperréactivité bronchique dans les asthmes sévères,
ainsi qu'au cours et au décours de certaines infections virales des voies
respiratoires.
D'autres cellules jouent
probablement un rôle dans la pathogénie de l'asthme : il s'agit notamment des
polynucléaires neutrophiles et des plaquettes, et des cellules endothéliales et
des fibroblastes pulmonaires.
Les
résultats d'études diverses, dont certaines déjà anciennes, ont montré la
présence d'un nombre élevé de polynucléaires neutrophiles et de plaquettes, et
une importante activation de ces cellules, dans la paroi et la lumière
bronchiques, chez les patients atteints d'asthme gravissime. De plus, les
plaquettes des sujets allergiques libèrent in vitro des substances
histaminolibératrices, encore mal identifiées, et des facteur(s) induisant une
hyperréactivité bronchique.
Les
cellules endothéliales produisent des médiateurs (PAF, LTB4, etc.) et des
cytokines proinflammatoires diverses, dont l'expression a été mise en évidence
sur le site des réactions allergiques ; les fibroblastes bronchiques, quant à
eux, produisent des cytokines et du collagène, qui pourraient être responsables
de la fibrose observée dans les asthmes sévères.
C - PHYSIOPATHOLOGIE DE L'HSI
1)
Anomalies de la synthèse des IgE
Comme cela a déjà été évoqué, des taux
élevés d'IgE sont couramment détectés dans le sérum et les secrétions des
patients atteints d'allergie immédiate, ainsi que dans le sang du cordon, chez
les nouveau-nés de parents atopiques.
Diverses
anomalies susceptibles d'expliquer cette production exagérée d'IgE ont été
détectées chez les atopiques, et notamment :
- une
augmentation du nombre et de l'activité des lymphocytes B à IgE, qui est
significativement corrélée avec la sévérité de la maladie ;
- une augmentation du nombre et de l'activité fonctionnelle des lymphocytes Te et Be, qui est plus ou moins bien corrélée avec une augmentation du taux plasmatique de l'antigène CD23 soluble et du taux des IgE sériques ;
- et surtout des modifications portant sur les lymphocytes Th1 et Th2 : ainsi, chez les atopiques, observe-t-on une augmentation du nombre des clones de lymphocytes Th2 et de la production des cytokines correspondantes, et une diminution relative du nombre des clones de lymphocytes Th1, et de la production d'IL-2 et, surtout, d'IFN-g.
2)
Pathogénie de la réaction allergique et
de l'hyper-réactivité périphérique
Les IgE, synthétisées et sécrétées suite aux contacts avec
les allergènes de l'environnement, se fixent sur les récepteurs exprimés sur la
membrane des cellules effectrices de l'allergie immédiate. Lors d'une nouvelle
exposition à l'allergène, ce dernier se fixe sur les IgE, elles mêmes fixées
sur la membrane des cellules effectrices, et induit une agrégation des
récepteurs pour les IgE ; cette agrégation est responsable d'une activation de
divers systèmes enzymatiques, induisant l'extrusion des granulations
intracytoplasmiques et la synthèse de médiateurs ("néo-formés"). La
réaction allergique, notamment dans les voies respiratoires, se déroule le plus
souvent en deux temps, avec :
- une
phase précoce, de survenue rapide (quelques minutes à quelques dizaines de
minutes après le contact avec l'allergène), caractérisée essentiellement par
des phénomènes vasculaires (oedème et érythème, exsudation) et par une
contraction des fibres musculaires lisses (bronchospasme, dans l'asthme) ;
- une
phase retardée (ou tardive), qui se développe progressivement dans le courant
des heures suivantes, et qui est essentiellement caractérisée par une réaction
inflammatoire lente à régresser.
Selon la conception classique, déjà un peu ancienne (Fig. 3), la phase immédiate de la réaction allergique du type immédiat résulterait de la libération rapide des médiateurs vasoactifs et constricteurs des fibres muscu-laires lisses (histamine notamment) par les mastocytes. L'activation des mastocytes conduit également, mais avec un certain retard, à la synthèse de médiateurs proinflammatoires divers (prostaglandines D2 et F2a, thromboxanes, leucotriènes, etc.), responsables d'un afflux local et d'une (pré)activation des cellules "effectrices secondaires" (éosinophiles, basophiles, macrophages, etc.), elles mêmes sensibilisées par des IgE et susceptibles d'être à leur tour activées par les allergènes, les médiateurs et facteurs proinflammatoires libérés par ces cellules étant à l'origine de la phase tardive, prolongée, de la réaction allergique. Les divers médiateurs impliqués, les cellules qui les produisent, et leurs principales activités biologiques sont indiqués dans les Tableaux III et IV.
La
conception plus récente de la phase tardive de la réaction allergique du type
immédiat (Fig. 4) tient compte du fait que la plupart des cellules effectrices
présentes sur le site de la réaction allergique (lymphocytes T, mastocytes et
basophiles, éosinophiles, macrophages, etc.) sont capables de produire des
cytokines pro-inflammatoires diverses, essentiellement du type Th2 (IL-4 et
IL-5 notamment), mais aussi non spécifiquement Th2 (IL-1 et 8, TNF, GM-CSF,
RANTES, etc.). Le rôle joué par ces cytokines dans la physiopathologie de la
réaction allergique du type immédiat est étayé par les résultats d'études
diverses qui montrent que :
- des
concentrations élevées de ces cytokines sont détectables sur le site de la
réaction allergique et dans le sang, et corrélées avec la sévérité de la
réaction allergique ;
- in
vitro et in vivo (expérimentation animale), ces cytokines stimulent la
prolifération, la différenciation, l'adhésion, le chimiotactisme et la survie
des cellules effectrices, et contribuent à (pré)activer ces cellules ;
- les
anticorps anti-cytokines et les antagonistes ou les inhibiteurs des cytokines
exerçent des effets anti-allergiques in vivo, chez l'animal ;
- la
désensibilisation spécifique (DS), enfin, induit une diminution de la
production de ces cytokines, qui est corrélée avec l'amélioration clinique des
malades.
Les
diverses cytokines impliquées, et leurs principales activités biologiques, sont
indiquées dans le Tableau V.
3)
Conception d’ensemble
Dans l’état actuel des connaissances, on considère donc
que le terrain atopique est un terrain génétiquement déterminé qui oriente les
réponses immunitaires aux allergènes vers une réponse immunitaire du type Th2
prédominant. Les cytokines produites par les LyTh2 activés par les allergènes
sont à la fois responsables d’une augmentation de la produc-tion des IgE et de
la prolifération, la différenciation, le recrutement et la (pré)activation des
cellules effectrices impliquées dans les réactions allergiques du type immédiat
(Fig. 5).
La
dégranulation mastocytaire, qui fait suite à la fixation des allergènes sur les
IgE, elles mêmes fixées sur la membrane mastocytaire, se traduit par la
libération rapide de médiateurs vaso-actifs et constricteurs des fibres
musculaires lisses (phase précoce), ainsi que par la libération plus lente,
mais prolongée, de médiateurs et de cytokines qui concourent à recruter et à
(pré)activer les autres cellules effectrices, sur le site de la réaction
allergique (phase tardive). Les mastocytes tiennent donc lieu de cellules
"starter", à l’origine d’une réaction inflam-matoire plus ou moins
durable, qui est entretenue par la fixation des allergènes sur les IgE fixées
sur la membrane des cellules ainsi recrutées et (pré)activées (éosinophiles
notamment, mais aussi macrophages, plaquettes, etc.), ainsi que par les
médiateurs et cytokines produits par ces cellules elles mêmes. C’est ce qui
explique que, à terme, seuls les médicaments anti-inflammatoires (corticoïdes
notamment) sont efficaces dans le traitement des maladies allergiques de sévérité
modérée ou importante.
A
plus ou moins long terme, les médiateurs et les enzymes libérés par les
cellules effectrices sont susceptibles d’induire des lésions irréversibles
(destruction des cellules épithéliales, fibrose), qui rendent les traitements moins
efficaces et plus aléatoires.
D – Allergènes et manifestations
cliniques de l’HSI
1)
Les allergènes
Les antigènes (ou allergènes) responsables des allergies de type immédiat sont extrêmement variés. Il s'agit presque toujours de protéines, ou bien d'haptènes qui deviennent immunogènes en se combinant avec des protéines de l'organisme.
La
classification des allergènes repose sur leur voie de pénétration dans
l'organisme : ainsi distingue-t-on les aéroallergènes (qui pénètrent essentiellement
par voie respiratoire, d'où leur ancienne dénomination de pneumallergènes, mais
aussi parfois par voie épicutanée), les trophallergènes (qui pénètrent par voie
digestive), et des allergènes divers, qui pénètrent dans l’organisme par des
voies variées (médicaments et substances biologiques notamment).
Les aéroallergènes : par ordre de fréquence décroissant, les aéroallergènes les plus répandus et les plus allergisants sont les acariens de la poussière de maison ("mites" dans la terminologie anglo-saxonne) ; il s'agit d'insectes microscopiques qui se nourrissent de squames humaines et animales, et sont particulièrement abondants dans la literie et les tissus d'ameublement. Dans la population générale, la prévalence des sensibilisations aux acariens est comprise entre 10 et 20 %, les valeurs les plus élevées (jusqu'à 30-40 %) étant observées dans les régions chaudes et humides, dont le climat favorise le développement des acariens. Une importante proportion des patients atteints d'allergie respiratoire sont sensibilisés aux acariens (environ 10 % des asthmatiques de moins de 2 ans, 25 % des asthmatiques de 2-6 ans, et près de 60 % des asthmatiques âgés de 6 ans et plus). Le risque de développer une allergie aux acariens est significa-tivement augmenté chez les atopiques exposés, pendant les premières semaines ou les premiers mois de la vie, à des taux élevés d'allergènes d'acariens (≥ 2,5 à 5 mg de Der p 1/gramme de poussière), et, chez les sujets sensibilisés, le risque de déclencher des symptômes (rhinite et/ou asthme) est d'autant plus élevé que le taux d'allergènes d'acariens dans la poussière de maison est élevé.
En
fréquence, la seconde catégorie d'aéroallergènes les plus sensibilisants sont
les pollens : on en distingue plusieurs types, selon leur origine (Tableau
VIII). La plupart des pollens sont allergisants, sous réserve d'être assez
petits et assez légers pour pouvoir être véhiculés à grande distance par le
vent et pénétrer facilement dans les voies respiratoires ; la pénétration des
allergènes polliniques dans les petites bronches peut être favorisée par la
fragmentation des grains de pollens et la "solubilisation" de leurs
allergènes par les dérivés de la combustion des hydrocarbures. Ceci pourrait
expliquer que, bien que la fréquence des tests cutanés positifs aux pollens
soit sensiblement la même chez les sujets vivant en milieu urbain et rural, la
prévalence des symptômes liés à une allergie pollinique est significativement
plus élevée en milieu urbain. La prévalence de l'allergie pollinique varie avec
l'âge : elle est relativement faible chez les enfants de moins de 6-8 ans (<
6 %), puis augmente progressivement jusqu'à l'âge adulte, pour atteindre 8 à 12
%. Elle varie également selon les régions (elle est très faible dans les régions
de montagne, relativement faible en bord de mer, et plus importante dans les
régions de plaine et de demi-montagne).
Les
poils et squames d’animaux (chat, chien, cheval, petits rongeurs, etc.)
représentent également des aéroallergènes importants ; ces allergènes, et
notamment ceux du chat, des chevaux et des petits rongeurs, peuvent persister
pendant de nombreux mois, voire plusieurs années, sur les sites contaminés. De
plus, ils sont extrêmement dispersibles, soit par voie aérienne, soit par
l'intermédiaire des vêtements des sujets en contact avec les animaux
correspondants : c'est ainsi que l'on a détecté des taux importants
d'allergènes de chat dans des lieux publics (écoles, hôpitaux, salles
d'attente), et rapporté cette contamination à la présence, dans ces locaux, de
sujets vivant en compagnie de chats.
On
peut citer encore de nombreux autres aéro-allergènes, comme des champignons
(moisissures), ou certains produits chimiques responsables d’allergies
respiratoires professionnelles (isocyanates, par exem-ple). Les moisissures
(atmosphériques, domestiques, et professionelles) peuvent aussi induire des
manifes-tations liées à une HS semi-retardée (HS du type III, par complexes
immuns), telles les alvéolites allergiques extrinsèques, également appelées pneumopathies
d'hypersensibilité (maladies du poumon de fermier, des éleveurs d'oiseaux, des
fromagers, etc.).
Les trophallergènes : les plus sensibilisants sont les protéines d'origine
animale (lait de vache, oeufs, poisson et viande). En dehors de ces protéines
animales, de très nombreux trophallergènes peuvent être recen-sés :
légumes avec, au premier plan, le céleri ; fruits avec surtout les fruits secs
(arachide notamment) et les agrumes ; etc... (Tableau IX). Certains aliments
présentent une allergénicité croisée avec d'autres aliments, généralement de la
même famille ou de familles voisines, ou avec des antigènes alimentaires comme
les pollens.
Les
allergies alimentaires d'apparition précoce (lait, soja, farine et oeuf,
notamment) guérissent avant l'âge de 3 à 4 ans dans environ les deux tiers des
cas ; toutefois, elles reflètent l'existence d'un terrain atopique, et évoluent
généralement vers une allergie respiratoire et/ou une allergie à d'autres
aliments au cours des années suivantes. Par contre, les allergies alimentaires
d'apparition plus tardive (viandes, poissons, crustacés et coquillages, fruits
et légumes) ne guérissent pratiquement jamais, et le développement à un nombre
croissant d'aliments est fréquent.
Si
les aliments peuvent induire de réelles manifestations d'allergie humorale
(rhinite, asthme, DA, urticaire et oedème de Quincke), certains d'entre eux
sont responsables de troubles pseudo-allergiques dus à leurs pro-priétés
histaminolibératrices non spécifiques (fraises et certains poissons, notamment)
ou à leur richesse en histamine (poissons : thon frais en particulier).
Médicaments et substances biologiques : de très nombreux médicaments et
substances biologiques (antibiotiques notamment, et tout particulièrement les
bêtalactamines ; hormones hétérologues, telles l’insuline et l’ACTH ; enzymes,
telle la chymopapaine ; latex des gants et des sondes ; etc.) sont
capables d'induire une sensibilisation et de provoquer des réactions
allergiques du type immédiat lors de leur réintroduction dans l'organisme.
2)
Manifestations cliniques de l’allergie
immédiate
Elles sont extrêmement variées, et peuvent toucher :
- la
peau (dermatite atopique, urticaire et/ou angio-oedème) ;
- les
voies respiratoires supérieures (rhinite ou rhinosinusite, souvent associée à
une conjonctivite ; laryngite ou trachéite, se traduisant par une toux
spasmodique ; oedème de Quincke, touchant la glotte et le larynx, et pouvant
être à l’origine d’une mort par asphyxie) ;
- les
voies bronchiques (asthme) ;
- le
tube digestif (vomissements, diarrhée ; certaines colopathies chroniques) ;
- le
système cardiovasculaire (choc anaphylactique).
E - L’anaphylaxie
1)
Aspects historiques
Le choc
anaphylactique fut décrit pour la première fois par Richet & Portier, qui
cherchaient à réaliser une accoutumance progressive à une toxine d'actinies
(actinocongestine) chez le chien. L'injection intraveineuse (IV) de cette
toxine à dose très faible ne provoquant aucun trouble, le protocole
expérimental prévoyait une augmentation progressive des doses, dans le but
d'obtenir l'accoutumance recherchée ; après une interruption fortuite de
l'expérimentation, celle-ci fut reprise 3 semaines plus tard, et, contre toute
attente, une dose minime de toxine induisit en quelques minutes un prurit
généralisé, une dyspnée, une tachycardie avec effondrement de la pression
sanguine, une hypothermie, des crises convulsives, enfin un coma d'évolution
fatale en moins d'une heure. L'hypothèse d'un effet toxique fut rapidement
écartée, la dose injectée étant minime, et les symptômes observés étant très
différents de ceux dus à la toxicité de l'actino-congestine ; aussi, le
phénomène observé reçut-il le nom d'anaphylaxie (= contraire de
protection).
Des
expériences effectuées ultérieurement dans diverses espèces animales, avec des
substances non toxiques (ovalbumine notamment), permirent de suggérer que les
mécanismes impliqués étaient de nature immunologique :
- nécessité
absolue d'injection(s) préparante(s), correspondant à la sensibilisation ;
- nécessité
d'un intervalle libre entre les injections préparantes et l'injection
déclenchante, correspondant au temps nécessaire à la production d'anticorps
anaphylactiques et à leur fixation sur les cellules effectrices ;
- enfin,
identité stricte (spécificité) entre la substance utilisée pour les injections
préparantes et celle utilisée pour l'injection déclenchante.
2)
Physiopathologie des réactions
anaphylactiques
Les preuves expérimentales du mécanisme de l'anaphylaxie furent
apportées par les expériences in vivo et in vitro qui furent réalisées
ultérieurement, et qui permirent de montrer que l'anaphylaxie était
transférable passivement par le sérum (anticorps), qu'elle résultait, pour
l'essentiel, de la dégranulation explosive et massive des mastocytes et des
basophiles, et que le principal médiateur en cause était l'histamine (Fig. 6).
Rôle des IgE : il a été mis en évidence par les expériences d'anaphylaxie passive
in vivo et in vitro. L’anaphylaxie passive généralisée consiste à sensibiliser
un animal indemne de toute sensibilisation active, en lui injectant du sérum
provenant d'animaux préalablement immunisés, et en déclenchant, chez cet
animal, un choc anaphylactique, par l'injection de l'antigène correspondant (expériences
de Nicolle & Richet) (Fig. 7). L’anaphylaxie passive localisée consiste à
sensibiliser passivement un animal par l'injection intradermique (ID) du sérum
provenant d'animaux immunisés, et à révéler cette sensibilisation par
l'injection, 24 à 48 heures plus tard, de l'antigène correspondant, soit par
voie ID, au lieu même de la sensibilisation passive (réaction de
Prausnitz-Küstner), soit par voie IV (réaction d'Ovary) ; il se produit alors,
dans la peau sensibilisée par les anticorps, un oedème, qui peut être révélé
par l'extra-vasation d'un colorant vital injecté par voie IV, la réaction étant
d'autant plus intense que la concentration des anticorps injectés dans le derme
est plus élevée. Les réactions anaphylactiques in vitro sont effectuées sur des
organes riches en fibres musculaires lisses (iléon ou corne utérine de cobaye,
poumon de singe), prélevés chez des animaux préalablement sensibilisés ; ces
organes sont alors placés dans un liquide de survie, puis mis en présence de
l'antigène adéquat. Il se produit alors une dégranulation des mastocytes, qui
se traduit par une contraction de l'organe isolé (phénomène de Schultz-Dale).
Une réaction analogue peut également être obtenue après sensibilisation passive
in vitro, par du sérum provenant d'un animal sensibilisé, d'un organe provenant
d'un animal indemne de toute sensibilisation ; on parle alors d'anaphylaxie
passive in vitro.
Il est clair que les IgE sont les anticorps responsables de ces réactions anaphylactiques, dans la mesure où le chauffage du sérum à 56° C (qui détruit le site de fixation des IgE sur leurs récepteurs) prévient leur développement. Par ailleurs, le rôle déterminant des IgE dans les réactions anaphylactiques a été confirmé récemment grâce aux études effectuées chez des souris présentant une anomalie des récepteurs FceRI, chez lesquelles il est pratiquement impossible d’induire une réaction anaphy-lactique.
Rôle des mastocytes : il est étayé par de nombreux arguments, parmi lesquels :
- l'existence
de signes de dégranulation mastocytaire massive (études immunohistologiques et
histochimiques des tissus), dans le coeur entre autres ;
- une
diminution considérable des concentrations tissulaires d'histamine, associée à
une augmentation du taux de l'histamine plasmatique et de l'excrétion urinaire
de la méthyl-histamine ;
- une
augmentation de la concentration plasmatique de la tryptase, particulièrement
marquée dans les réactions anaphylactiques sévères ;
- les
résultats des études effectuées chez les souris congénitalement dépourvues de
mastocytes (W/Wv et Sl/Sld), chez lesquelles il est impossible d'induire un
choc anaphylactique (Tableau VI).
Médiateurs de l’anaphylaxie : le principal médiateur de l’anaphylaxie est l’histamine,
comme en témoignent de nombreux arguments, parmi lesquels :
- une
importante augmentation des concentrations plasmatiques d’histamine et
urinaires de méthyl-histamine ;
- la
reproduction des principaux signes cliniques et des principales modifications
cardiovasculaires et biologiques par les injections IV d'histamine (choc
histaminique) ;
- les
effets protecteurs, partiels mais importants, des antihistaminiques H1, alors
que, par ses effets H2, l’histamine exercerait plutôt une action
anti-anaphylactique.
Pendant
longtemps, on a pensé que les effets cardiovasculaires de l’histamine
résultaient de son action directe sur la paroi vasculaire et le muscle
cardiaque ; toutefois, les résultats d’études récentes suggérent forte-ment que
ces effets de l’histamine résultent d’une stimu-lation de la production de NO
(monoxyde d’azote) par les cellules endothéliales et, peut-être par d’autres
cellules (cellules musculaires lisses, etc.....).
Mis
à part l’histamine, d’autres médiateurs, tels le PAF et les leucotriènes, et,
peut-être, certaines cytokines, pourraient jouer un rôle dans la prolongation
et/ou l’aggravation de certains chocs anaphylactiques.
Interactions entre le système immunitaire et le système
neuro-endocrinien
: dans la mesure où des chocs anaphylactiques sévères ont été rapportés chez
des sujets faiblement sensibilisés, certains auteurs ont postulé que la
survenue de ces chocs pourrait être facilitée par des anomalies sous-jacentes
des mécanismes neuro-endocriniens contrôlant la pression sanguine.
C’est
ainsi qu’il a été montré récemment que les taux plasmatiques et/ou
intra-leucocytaires de l’angiotensine, l’angiotensinogène et la rénine étaient
significativement plus faibles chez les sujets ayant présenté des réactions
anaphylactiques sévères, aux venins d’hyménoptères notamment, que chez les témoins
non allergiques, et étaient normalisés par la désensibilisation.
Par
ailleurs, il est clair que le déclenchement des réac-tions anaphylactiques est
favorisé par certaines situa-tions qui s'accompagnent d'une diminution, faisant
le plus souvent suite à une augmentation transitoire, de la production endogène
des corticostéroïdes et des catécholamines (effort physique important ;
certains traitements hormonaux ; stresses importants, physiques ou
psychiques).
3)
L’anaphylaxie humaine
Dans l'espèce humaine, les réactions anaphylactiques
associent plus ou moins complètement, et selon une chronologie le plus souvent
stéréotypée, des signes cutanés (urticaire ± angio-oedème), respiratoires
(bronchospasme et/ou oedème laryngé), et cardiovasculaires (hypotension plus ou
moins profonde, tachycardie réactionnelle, et parfois arrêt cardiaque). Des
troubles neurologiques (confusion, crises convulsives, parfois coma), résultant
de l’anoxie cérébrale, peuvent être observés dans les chocs sévères.
Si
des réactions anaphylactiques plus ou moins sévères peuvent survenir chez des
atopiques allergiques à un allergène donné, lorsqu’ils entrent en contact avec
cet allergène (aliment le plus souvent), les réactions anaphylactiques ont pour
particularité de pouvoir survenir chez des sujets non prédisposés par un
terrain atopique (Tableau VII). Ceci résulte probablement de la nature
particulièrement immunogène des substances anaphylactogènes (cf. ci-dessous),
ainsi que des condi-tions dans lesquelles s’effectue généralement leur pénétration
dans l’organisme (ingestion, injection).
De
nombreuses substances sont susceptibles d'induire un choc anaphylactique dans
l'espèce humaine, parmi lesquelles, notamment :
- les
sérums hétérologues (antitétanique et anti-diphtérique d'origine équine),
historiquement ; actuel-lement, des sérums d'origine humaine leur sont
préférés, et le risque est beaucoup plus faible. Il n'en reste pas moins que
certains sérums d'origine animale sont à nou-veau utilisés (anticorps
monoclonaux antilympho-cytaires notamment), et sont parfois à l'origine de
chocs anaphylactiques ;
- les médicaments et substances biologiques : la liste des médicaments et substances biologiques susceptibles d'induire un choc anaphylactique est très longue. A titre indicatif, les plus fréquemment en cause sont les bêtalactamines, et notamment la pénicilline ; viennent ensuite les anesthésiques généraux (myorelaxants notamment), l'ACTH (y compris de synthèse), la glafé-nine, la vitamine B12, la chymopapaïne (chimio-nucléolyse discale), le latex, etc..... Le risque d'accident anaphylactique est plus élevé lorsque la pénétration s'effectue par voie parentérale, du fait de la diffusion rapide de l'allergène dans l'organisme ; enfin, les anti-hypertenseurs (b-bloquants notamment) constituent un facteur d'aggravation du choc anaphylactique et de résistance au traitement ;
- les
produits sanguins d'origine humaine : des réactions anaphylactiques ont été
observées chez des sujets recevant des perfusions de plasma ou des injections
de gammaglobulines humaines, notamment chez les mala-des atteints de déficit en
IgA. Deux mécanismes ont été incriminés pour expliquer ces réactions : une
allergie à certaines protéines constitutives du plasma ou des gammaglobulines ;
une allergie à un allergène exogène, malencontreusement présent dans le produit
sanguin administré (aliment, médicament) ;
- allergènes
divers : ils sont très nombreux. Il peut s'agir, entre autres, d'allergènes
alimentaires, des venins d'hyménoptères (les chocs anaphylactiques qu'ils sont susceptibles
d'induire étant probablement une cause non exceptionnelle de morts d'apparence
spontanée), de pollens ou phanères animales (des réactions anaphylactiques
sévères ayant été rapportées lors de séances de tests cutanés et lors de
désensibilisations), et d'antigènes parasitaires ; en effet, il est bien connu
que certaines parasitoses s'accompagnent de taux élevés d'IgE sériques totales
et spécifiques, et des chocs anaphylactiques sévères ont été rapportés lors
d'une irruption massive d'antigènes parasitaires dans l'organisme (rupture de
kyste hydatique, traitement massif de certaines nématodoses). Enfin, des chocs
anaphylactiques liés à la contamination d'aliments par des acariens, des
moisissures et des allergènes du latex ont été rapportés récemment.
4)
Diagnostic différentiel
Le diagnostic de choc anaphylactique n'est pas toujours
aisé, notamment du fait de la méconnaissance des antécédents (notion de
sensibilisation antérieure souvent méconnue, etc...). De plus, comme cela a déjà
été évoqué, les chocs anaphylactiques peuvent se produire chez des sujets non
atopiques ; enfin, certaines manifestations peuvent ressembler à s'y méprendre
à un choc anaphylactique. Il en est ainsi, notamment :
- des
chocs anaphylactoïdes, qui peuvent résulter tantôt d'une histaminolibération
directe, tantôt d'une activation mastocytaire par des facteurs du complément
activé (anaphylatoxines C3a et C5a) par certaines subs-tances d'origine
médicamenteuse (substituts du plasma, antibiotiques comme la colistine, plasmas
mal conservés, produits de contraste) ou non médicamenteuse (Fig. 6 et Tableau
VII). C’est pourquoi il importe d’effectuer des dosages systématiques du
complément hémolytique, du C3 et du C4, chez tout sujet présentant un choc
anaphylactique ou anaphylactoïde, notamment en milieu chirurgical et en
anesthésie-réanimation ; ces dosages compléteront utilement le bilan de base
(dosages de l’histamine et la tryptase plasmatiques, et de la méthyl-histamine
urinaire), et permettront d’orienter le diagnostic étiologique effectué a
posteriori. Quoiqu'il en soit, le traitement du choc anaphylactoïde est
identique à celui du choc anaphylactique ;
- des
syncopes vagales, mais généralement régressives spontanément en quelques
minutes ;
- des
chocs toxi-infectieux ou post-traumatiques, qui peuvent survenir chez des
sujets hospitalisés dans des services de réanimation, et qui peuvent poser des
problèmes de diagnostic différentiel avec un choc anaphylactique ou
anaphylactoïde d'origine médicamenteuse ;
- enfin,
des dyspnées laryngées d'origines diverses (inhalation de corps étranger chez
l'enfant, notamment), et qui peuvent ressembler à un choc anaphylactique à
prédominance respiratoire.
II - diagnostic et
traitement de l'allergie immédiate
A – Grands principes du diagnostic
allergologique
L'enquête
allergologique comporte deux temps : la reconnaissance du terrain atopique et
l'identification du/des allergène(s) en cause. Pour ce faire, et en dépit de
méthodes immunologiques de plus en plus nombreuses et précises, l'enquête
clinique, basée sur l'interrogatoire et les tests in vivo, reste fondamentale.
1)
Reconnaissance du terrain atopique
Elle est le plus souvent aisée à faire, sur la base des
renseignements fournis par l'interrogatoire et, éventuellement, par quelques
examens biologiques d'appoint.
L'interrogatoire recherche des antécédents d'atopie :
- familiaux,
le risque étant d'autant plus élevé que le nombre des sujets atteints dans la
famille proche (parents, fratrie) est élevé. Toutefois, l'absence d'antécédents
familiaux n'exclut pas le risque, pour un enfant, d'être atopique ;
-
personnels (DA et bronchiolites, chez le jeune enfant ;
rhinite/rhinoconjonctivite et asthme, ultérieurement), qui font la preuve
(quasi)certaine d'un terrain atopique.
Examens biologiques : ils sont indiqués lorsque les antécédents évocateurs
font défaut ou sont incertains. Les examens les plus courants et les plus
fiables sont :
- la
NFS, à la recherche d'une éosinophilie supérieure ou égale à 4 % des leucocytes
(soit 400 par mm3). Elle est inconstante, mais fréquente, et ne peut être
reconnue comme indice d'atopie qu'après avoir éliminé les autres causes
d'hyperéosinophilie, parasitoses et maladies de système notamment ;
- le
dosage des IgE sériques totales : il est généralement effectué par la méthode
du PRIST (paper radioimmunosorbent test : Fig. 1 et 2). Par cette méthode, on
peut considérer comme pathologiques des taux supérieurs ou égaux à 1 U/ ml à la
naissance (sang de cordon), 5 U/ml entre 1 et 3 mois, et 10 U/ml entre 4
et 6 mois, puis, jusqu'à l'âge de 12 ans, une augmen-tation supérieure à 15 ou
20 U/ml par année. Chez l'ado-lescent et l'adulte, la limite supérieure de
la normale se situe aux alentours de 200 à 250 U/ml. Une hyper-IgE-globulinémie
est couramment observée dans l'asthme, la DA et les syndromes
dermorespiratoires ; mais, là enco-re, doivent être exclues les autres causes
d'hyper-IgE-globulinémie ;
- les
tests multiallergéniques non quantitatifs de dépistage, dont la positivité
reflète l'existence d'une sensibilisation vis à vis d'un ou de plusieurs
allergène(s) d'un mélange de pneumallergènes (Phadiatop©) ou de
pneu-mallergènes et de trophallergènes courants (Alatop©) (Fig. 3). La valeur
prédictive de ces tests est de l'ordre de 50 à 60 % avant l'âge de 4 ans, et de
90 à 95 % ultérieurement.
D'autres
examens biologiques peuvent être utilisés pour le dépistage de l'allergie
immédiate. Il s'agit :
- du
dosage des IgE dans les sécrétions, notamment dans les larmes (conjonctivites)
;
- de
la recherche d'une éosinophilie supérieure ou égale à 10 % dans les sécrétions
nasales (rhinites) ou bronchiques (asthme), où l'augmentation du nombre des
éosinophiles est positivement et significativement corrélée avec la sévérité de
la maladie.
En
pratique, ces examens ne sont effectués que très exceptionnellement, et plutôt
pour éliminer une étio-logie allergique que pour la confirmer.
Cas particulier de l'allergie respiratoire : sont très évocateurs d'une
rhinite ou rhinosinusite, mais aussi d'un asthme allergiques :
- l'aspect
de la muqueuse nasale, de couleur lilas, pâle, oedémaciée, brillante, avec une
fréquente hyper-trophie des cornets inférieurs ;
- un
aspect en cadre des sinus maxillaires (RX des sinus, en incidence de Blondeau).
Seront
également recherchés systématiquement, par l'interrogatoire, l'examen clinique
et la radiographie, des foyers infectieux ORL et stomatologiques ; ils sont en
effet fréquemment associés à une allergie respiratoire, et en majorent
l'expression.
2)
Identification des allergènes
Elle repose essentiellement sur les données fournies par
l'interrogatoire, et sur les tests cutanés (TC) à lecture immédiate.
L'interrogatoire permet, dans la grande majorité des cas, de suspecter un
ou plusieurs allergène(s). Des notions importantes doivent être précisées :
- le
mode de début et les circonstances d'apparition des premières manifestations
cliniques (déménagement, reclassement professionnel, acquisition d'un animal
familier, etc.) ;
- le
caractère saisonnier ou non des troubles : des manifestations perenniales à
recrudescence automno-hivernale sont très évocatrices d'une allergie aux
aca-riens, alors que des manifestations verno-estivales évo-quent plutôt une
allergie pollinique ou à certaines moi-sissures atmosphériques. En l'absence de
prédominance saisonnière, il faut évoquer un contact permanent avec des
allergènes de l'environnement quotidien (animaux familiers ; allergènes
professionnels, pour lesquels les troubles s'amendent généralement pendant les
congés) ou portés par le malade (allergie bactérienne, certaines allergies
fongiques), ou bien encore une polysensibi-lisation à de multiples allergènes
échelonnés dans le temps (poussière et acariens, pollens, etc.) ;
- le
lieu géographique (milieu habituel, déplacement à la campagne, etc.), et les
conditions de logement. C'est ainsi, par exemple, que des symptômes liés à une
allergie aux acariens peuvent être faussement attribués à une allergie
pollinique, chez un sujet séjournant au printemps dans une maison de campagne
ancienne et humide, riche en acariens. En ce qui concerne les conditions de
logement, doivent notamment être précisées avec soin la composition des sols
(tapis, moquettes, etc.), celle de la literie, l'humidité (traces de
moisissures), le mode de chauffage, et la présence d'animaux familiers ;
- les
conditions climatiques favorisant le déclenchement des troubles : l'expression
d'une allergie à la poussière et aux acariens est généralement favorisée par un
temps froid et humide, incitant au chauffage et au calfeutrage des habitations,
alors qu'un temps chaud et sec est propice aux manifestations liées à une
allergie pollinique ;
- la
profession et les conditions de travail, à la recherche d'une possible allergie
professionnelle ;
- enfin,
d'éventuels facteurs déclenchants parti-culiers : contacts avec des animaux ;
ingestion d'ali-ments ou de médicaments ; loisirs (équitation, brico-lage) ;
contacts avec des proches exerçant des activités particulières,
professionnelles ou non ; effort physique (asthme d'effort, allergie
alimentaire), etc.
Les tests cutanés (TC) ont pour but de confirmer l'existence d'une
sensibilisation à un ou plusieurs des allergènes soupçonnés à l'interrogatoire
: les TC à lecture immédiate consistent à introduire dans le derme une très
faible quantité d'allergène (cf. fig. 4), soit :
- en
piquant au travers d'une goutte d'extrait allergénique, préalablement déposée
sur la peau (prick-test) ;
- par
injection directe (IDR) ;
- éventuellement
par scratch-tests, où l'allergène (aliments frais en particulier) est déposé
sur la peau légèrement abrasée.
Chaque
série de tests doit comporter un témoin négatif (solvant), afin d'éliminer tout
dermographisme, et un témoin positif (histamine ou phosphate de codéine), afin
de contrôler la réactivité cutanée. Une hyporéactivité cutanée peut en effet
être observée chez les jeunes enfants et les sujets âgés, ainsi que chez les
malades hémodialysés, et chez ceux recevant des anti-histaminiques, des
anxiolytiques ou des anti-dépresseurs ; il est donc souhaitable
d'interrompre ces médicaments plusieurs jours, voire plusieurs semaines, avant
la séance de tests.
La
lecture de ces tests s'effectue à la 15e/20e minute, et leur interprétation
repose sur la mesure des diamètres de la papule et de l'érythème ; dans
certains cas, il est possible d'observer une réaction retardée, après la 6e/8e
heure. La survenue d'une réaction "syndromique" d'aggravation ou
d'amélioration des symptômes, au décours des TC, est un bon argument
diagnostique. Le risque de survenue d'une telle réaction impose une
surveillance d'au moins 30 mn. après la pratique des TC (IDR et scratch-tests
notamment).
La
valeur diagnostique des TC à lecture immédiate dépend de :
- la
nature et du degré de purification et de standardisation des extraits
allergéniques : elle est bonne pour la plupart des pneumallergènes, les venins
d'hyménoptères, le latex et quelques rares médicaments (notamment les
pénicillines et autres bêtalactamines, certaines enzymes et hormones, et les
myorelaxants) ; elle est variable pour les trophallergènes, et généralement
mauvaise pour les allergènes industriels ;
- la
concordance avec les données de l'interroga-toire : elle est bonne lorsque
cette concordance est bonne, alors que des TC isolément positifs, en dehors de
tout contexte clinique, ne présentent aucune valeur diagnostique.
Tests in vitro : quel que soit le test, il est bon de se rappeler qu'un résultat
positif ne reflète pas obligatoirement une sensibilisation pathogène (il existe
ainsi des sujets sensibilisés, mais qui ne manifestent aucune réaction
allergique lorsqu'ils entrent en contact avec l'allergène), et qu'un résultat
négatif ne signifie pas que le sujet n'est pas allergique à l'allergène étudié.
* Tests
de détection, et dosages des IgE sériques spécifiques : il existe plusieurs
catégories de tests utilisables par l'allergologue :
- les
tests d'orientation par groupe d'allergène : ils donnent une réponse purement
qualitative, mais permettent d'explorer les IgE spécifiques d'un groupe
d'allergènes (Fig. 5 & tableau 1) ;
- les
tests multiallergéniques à réponse quanti-tative par allergène (Fig. 6) : ils
permettent d'explorer une importante quantité d'allergènes (Matrix©,
MAST-CLA©), de préciser la spécificité des IgE détectées, et d'en apprécier les
taux de façon semi-quantitative. La valeur diagnostique de ces tests est bonne
pour la plupart des pneumallergènes, et très variable pour les trophallergènes
; de toutes façons, elle est inférieure à celle des TC et des RAST. Compte-tenu
des importants problèmes d'interprétation qu'ils posent, ces tests ne
présentent d'intérêt que chez les sujets polysensibilisés et atteints
d'allergies complexes. En aucun cas, ils ne peuvent ni ne doivent servir
d'examens de dépistage systématique ;
- les
tests monospécifiques, enfin : essentiellement basés sur des méthodes
radioimmunologiques (RAST, CAP-RAST : Fig. 7 et Tableau 2), mais parfois
fluorimétriques (FAST) ou immuno-enzymatiques (ELISA), ils permettent de
détecter les IgE sériques spécifiques de la plupart des allergènes courants, et
d'en déterminer les taux ; ceux-çi sont exprimés en unités par ml et/ou en
classes, selon la correspondance indiquée dans le tableau II ; seuls les taux
de classe égale ou supérieure à la classe 2 peuvent être considérés comme
significatifs. Pour la majorité des allergènes courants, il existe une bonne
correspondance avec les résultats des TC.
* Tests
divers : il s'agit des tests d'activation cellulaire (Fig. 8), tels le test de
la dégranulation des basophiles humains (TDBH, par une méthode optique) et le
test de l'histamine-release (méthode immuno-fluorimétrique), qui permettent de
mettre en évidence des IgE spécifiques fixées sur la membrane des basophiles
sanguins. Mises en présence de l'allergène, ces cellules se dégranulent, ne peuvent
plus être vues après coloration spécifique (TDBH), et libèrent de l'histamine
qui peut être dosée dans le surnageant (test de l'histamine release). Peuvent
également être dosés dans le surna-geant les leucotriènes (LTs), ou étudiés des
marqueurs d'activation membranaire (molécules d'adhésion inter-cellulaire,
etc.).
La
valeur diagnostique de ces tests est très variable selon la nature des
allergènes, la qualité des extraits, et la rigueur avec laquelle ils sont
effectués.
Ces
tests ne doivent être utilisés qu'exceptionnellement, par exemple lorsqu'il
n'existe pas d'extraits pour TC ou de RAST (certains aliments, nombreux
médicaments), et ne devraient être prescrits que par des allergologues
confirmés.
Les tests de provocation (TP) consistent à reproduire chez un malade, si
possible a minima, les symptômes de sa maladie, par l'administration prudente
d'un allergène dont on cherche à prouver la responsabilité. Selon la voie
d'introduction et la nature de l'allergène, on distingue :
- les
TP par injection (généralement sous-cutanée) de l'allergène (pratiquement
abandonnés, sauf dans quelques rares cas d'allergie médicamenteuse, avec TC
et/ou RASTs négatifs) ;
- les
TP par voie nasale (rhinites, asthmes sévères) ;
- les
TP par voie bronchique (asthmes bénins et modérés) : ces tests consistent,
après détermination du VEMS et du rapport de Tiffeneau (VEMS/CV), de la courbe
débit-volume ou des résistances bronchiques, à faire inhaler au sujet des
quantités croissantes de l'allergène incriminé, jusqu'à l'obtention d'une
modification significative des paramètres EFR étudiés ;
- les
TP par voie orale, aux aliments et aux médicaments : ces tests consistent à
réintroduire l'aliment ou le médicament incriminé par la voie buccale, à des
doses progressivement croissantes, et à étudier les réactions du sujet (signes
cardiovasculaires, respiratoires, cutanés, etc.) dans les minutes ou heures
suivantes.
Ces
tests de provocation, extrêmement précieux pour démontrer avec une
quasi-certitude la culpabilité de l'allergène, ne sont pas dénués de dangers,
et doivent donc être effectués en milieu hospitalier, en prenant de très
strictes précautions ; d'une façon générale, ils sont à proscrire lorsque
l'allergène à utiliser est soupçonné d'avoir déclenché un choc anaphylactique,
comme c'est notamment le cas avec certains aliments ou médicaments.
3)
Conclusions
Le plus souvent, le médecin généraliste, le pédiatre, le
pneumologue ou le dermatologue peuvent porter le diagnostic positif d'atopie
sur les données de l'interrogatoire (antécédents personnels et familiaux), et
en s'aidant éventuellement d'examens complémentaires simples (NFS, dosage des
IgE sériques totales ou Phadiatop©) ; de même, par l'interrogatoire,
éventuellement complété par une recherche d'IgE sériques spécifiques de groupes
d'allergènes, ils peuvent suspecter le(s) type(s) d'allergènes en cause.
Dans
un second temps, l'allergologue devra confirmer la nature allergique des
manifestations cliniques et, surtout, déterminer avec précision le(s)
allergène(s) responsable(s). Pour ce faire, sur la base des renseigne-ments
fournis par un interrogatoire soigneux, il effectuera des tests cutanés, dont
la valeur diagnostique est incontestable lorsque les résultats concordent avec
la clinique et les données de l'interrogatoire. Lorsqu'exis-tent des
discordances, le diagnostic étiologique repose sur des examens biologiques plus
ou moins sophistiqués (RAST, tests multiallergéniques à réponse quantitative
par allergène, plus rarement Tests d'activation cellu-laire), et surtout sur
des tests de provocation appropriés.
L'ensemble
de cette démarche diagnostique est schématisé dans le Tableau 3.
B – Les traitements spécifiques de
l’allergie immédiate
Ils ne sont indiqués que
lorsque le(s) allergène(s) en cause a (ont) bien été identifié(s) (voir
ci-dessus).
1)
Eviction du (des) allergène(s)
responsable(s)
C'est
la solution la plus simple et la meilleure, quand elle est possible et peut
être réalisée de façon complète. Par exemple :
- éviction
d'un animal domestique, à l'origine de manifestations allergiques. Toutefois,
il n'est pas inutile de rappeler que les allergènes animaux (chat notamment)
sont extrêmement tenaces, peuvent persister pendant plusieurs mois dans un
habitat après l'éviction, et peuvent même être détectés dans la poussière
d'habitats dépourvus de l'animal correspondant.
- suppression
d'un allergène alimentaire peu courant (viande de cheval, crustacés), ou peu
susceptible d'exister sous forme masquée dans d'autres aliments (poisson).
L'éviction
est plus difficile pour les allergènes ubiquitaires tels la poussière de maison
et ses acariens ; on peut néanmoins diminuer les effets nocifs de ces
allergènes en aménageant l'ameublement et en utilisant de façon régulière des
acaricides ; on peut aussi préconiser des séjours en altitude, dont l'effet
bénéfique est en grande partie liée à la disparition des acariens au
dessus de 1 200 à 1 500 mètres.
2)
L'immunothérapie spécifique (ou
désensibilisation)
Bien qu'il existe plusieurs méthodes de désensibilisation
(DS), le principe général de la DS repose sur l'administration régulière, à
doses généralement croissantes, jusqu'à une dose maximale efficace et bien
tolérée, du/des allergène(s) au(x)quel(s) le sujet est allergique. La DS induit
un état de tolérance du sujet aux allergènes auxquels il est désensibilisé, ou,
pour tout le moins, une diminution de sa sensibilité à ces allergènes
Indications de la désensibilisation : toutes les études sérieuses
effectuées à ce jour montrent que la désensibilisation :
* doit
être réservée aux allergies du type immédiat, à l'exception peut-être de
quelques rares cas d'HSR microbienne ou fongique ;
* ne
doit être envisagée que lorsque :
- la
responsabilité de l'allergène est formellement prouvée (cf. Diagnostic
allergologique) ;
- l'éviction
de l'allergène est difficilement réalisable, voire impossible ;
- les
manifestations allergiques sont suffisamment fréquentes et/ou sévères (à apprécier
sur la consommation médicamenteuse et/ou le risque vital) ;
* ne
peut être initiée que chez les sujets dont les manifestations allergiques sont
bien contrôlées par un traitement médical adapté (asthme notamment).
C'est
ainsi que peuvent bénéficier de la DS :
- avant
tout, les manifestations respiratoires (rhinites, toux spasmodique, asthme) et
oculaires (conjonctivites, blépharo et kératoconjonctivites) liées à une
allergie aux pneumallergènes (poussières et acariens, phanères d'animaux, et pollens
notamment) ;
- certaines
manifestations cutanées pures (DA) ou associées (syndromes dermorespiratoires),
habituellement difficiles à désensibiliser ;
- les
allergies aux venins d'hyménoptères, enfin.
Méthodes
: il en existe plusieurs, suivant la nature de l'extrait allergénique, la voie
d'administration de cet extrait, et les modalités d'administration de
l'allergène (période de l'année, rapidité de la progression initiale, etc.).
Les
extraits allergéniques les plus couramment utilisés sont des extraits
injectables par voie SC : ils peuvent être aqueux (soit tout-prêts, soit
lyophilisés, à reconstituer alors avec le solvant) ou retard (extraits adsorbés
sur hydroxyde d'aluminium, phosphate de calcium, etc.). Les autres extraits
(allergoïdes obtenus par polymérisation ; allergènes conjugués à des
macromolécules) n'ont pas fait preuve de leur supériorité et sont assez peu
utilisés ; des essais de DS par injections de conjugués allergènes-liposomes,
de petits fragments d'allergènes (peptides allergéniques) ou de complexes
immuns (allergènes-IgG spécifiques) sont en cours. Enfin, des extraits
administrables par voie buccale, sublinguale, nasale ou bronchique ont été mis
au point par divers laboratoires ; les doses à administrer sont très élevées, et
leur efficacité est controversée.
Selon
la période de l'année à laquelle sont administrés les extraits allergéniques,
on distingue les méthodes présaisonnières, où l'extrait allergénique est
administré pendant les mois qui précèdent la période d'exposition allergénique
(surtout utilisée pour les allergènes saisonniers, pollens notamment), et les
méthodes cosaisonnières, où l'allergène est administré pendant la période
d'exposition (essentiellement applicable aux allergènes perenniaux tels les
poussières et les acariens, les phanères d'animaux domestiques, etc.).
Enfin,
les méthodes de DS varient selon la vitesse avec laquelle la progression des
doses d'allergène est réalisée : la méthode usuelle (méthode ascentionnelle
classique) consiste à injecter, tout d'abord une à deux fois par semaine, puis
une fois toutes les deux à trois semaines, des doses progressivement
croissantes d'extrait allergénique ; la dose maximale d'entretien, à la fois
efficace et bien tolérée, n'est alors atteinte qu'après pluaieurs mois.
Certaines
méthodes (hyperaccélérées, accélérées, semi-accélérées) permettent d'atteindre
la dose maximale efficace en quelques jours ou semaines ; les injections
d'allergène doivent être effectuées en milieu hospitalier tant que la dose
d'entretien n'est pas atteinte et/ou est mal tolérée. Ces méthodes sont
essentiellement applicables aux venins d'hyménoptères, et parfois à d'autres
allergènes (acariens, pollens, phanères), lorsqu'un résultat rapide est
souhaité ; leurs indications sont limitées par la fréquence élevée, et parfois
la sévérité, des complications pendant la période ascensionnelle rapide.
Quelles
que soient la méthode et les extraits utilisés, la DS obéit à quelques règles
simples mais essentielles :
- sauf
dans des cas très précis (protocoles standar-disés des DS hyperaccélérées,
accélérées ou semi-accélérées), les doses de départ doivent être d'autant plus
faibles et la progression d'autant plus lente que l'allergie est sévère ;
- chez
les sujets polysensibilisés, il est inutile, voire néfaste, d'effectuer
d'emblée une DS à l'ensemble des allergènes en cause : la DS doit être
commencée avec l'allergène (ou la famille d'allergènes) le plus gênant, quitte
à introduire les années suivantes une DS associée avec un second, voire un
troisième allergène ;
- la
DS doit faire la preuve de son efficacité dès le 3e/6e mois pour les allergènes
perannuels, et dès l'année suivante pour les allergènes saisonniers. Toute
absence d'amélioration dans ces délais, et a fortiori toute aggravation, impose
de reconsidérer les modalités de la DS : choix du/des allergène(s), type
d'extrait utilisé, rythme des injections, rapidité de la progression, etc. ;
- enfin,
les injections d'entretien doivent être effectuées pendant au moins 3 ans,
voire 4 à 5 ans, pour que l'efficacité de la DS soit durable.
Mécanismes d'action de la désensibilisation : il s'agit notamment de
modifications portant sur la production de diverses classes anticorps, la
réactivité lymphocytaire, et la réactivité des organes-cibles (diminution de la
réactivité cutanée, nasale ou bronchique) à l'allergène, et sur la réactivité
des cellules effectrices (diminution de l'activabilité des basophiles sanguins,
mastocytes et éosinophiles tissulaires, et plaquettes, et de la libération de
médiateurs par ces cellules). Sur la base des résultats des études récentes, on
peut penser que ces modifications résultent, pour l'essentiel, d'une
normalisation de la réponse immunitaire Th1/Th2, s'accompagnant d'une
diminution de la production des cytokines pro-allergiques et
pro-inflammatoires, et d'une augmentation de la production des cytokines
"anti-allergiques" et anti-inflammatoires.
(a) Anciennes hypothèses
(modifications de la production des anticorps) :
- Modifications
de la production des IgE : une diminution importante du taux des IgE
totales et spécifiques est observée dans le sérum des sujets désensibilisés,
pendant la période d’entretien de la DS . Chez les allergiques à des allergènes
perannuels, le taux des IgE sériques devient significativement inférieur au
taux détecté avant le début de la DS (Fig. 1) ; dans les allergies aux
allergènes saisonniers, tels les pollens, le taux des IgE sériques n’augmente
pas, ou que peu, pendant la période d’exposition naturelle à l’allergène.
Au
moins en théorie, cette diminution du taux des IgE pourrait à elle-seule
expliquer une réduction de la réactivité à l’allergène, tout simplement en
diminuant le nombre des IgE fixées sur les cellules effectrices : en effet,
bien que le pontage de deux molécules d’IgE voisines soit suffisant pour
induire une activation cellulaire, il a bien été montré que la dégranulation
des basophiles et des mastocytes dépendait de la concentration des IgE sur la
membrane de ces cellules, et était proportionnelle au degré d’agrégation des
récepteurs pour les IgE.
- Modifications
portant sur les IgG spécifiques : la DS induit le plus souvent une augmentation
progressive du taux des IgG sériques spécifiques, qui affecte essentiellement
les IgG4 (Fig. 2). Pour un certain nombre d’auteurs, cette augmentation
est positivement et significativement corrélée avec l’efficacité clinique de la
DS et avec la diminution du taux des IgE sériques. Deux mécanismes pourraient
expliquer les effets bénéfiques de ces IgG(4) :
> tout
d’abord, un effet inhibiteur sur les réponses immunitaires, et tout
particulièrement sur la production des IgE. Les mécanismes susceptibles
d’expliquer cet effet inhibiteur des IgG (et des CI à IgG) sur la production
des IgE ne sont pas encore parfaitement élucidés : ont été proposées une
modification de la présentation des antigènes aux lymphocytes T, une
inactivation directe des lymphocytes et/ou une inhibition par des cellules
suppressives, et l’induction d’une réponse à anticorps anti-idiotypiques ;
> ensuite,
un effet "bloquant " des IgG (4 notamment) sur la phase effectrice de
la réaction allergique (activation des mastocytes et des basophiles). Les
mécanismes susceptibles d’expliquer l'effet inhibiteur des IgG spécifiques sur
la fixation des allergènes sur les IgE et sur l’activation des cellules
effectrices ne sont pas complètement élucidés : diverses hypothèses ont été
proposées, parmi lesquelles une fixation des IgG sur des épitopes également
reconnus par les IgE ("blocage" direct), une fixation des IgG sur des
épitopes distincts, mais induisant une modification conformationnelle de
l’allergène ou une obstruction spatiale masquant les épitopes reconnus par les
IgE ("blocage" indirect), et, enfin, l’induction de signaux
inhibiteurs par la combinaison de l’allergène aux IgG fixées sur la membrane
des cellules effectrices.
- Modifications portant sur les auto-anticorps anti-IgE : des taux plus ou moins élevés d’anti-IgE, appartenant essentiellement aux sous-classes des IgG1 et 4, ont été détectés dans le sérum des allergiques. En ce qui concerne les modifications induites par la DS, des résultats contradictoires ont été rapportés, avec une augmentation du taux des anti-IgE dans les DS aux pneumallergènes, et une augmentation de leur taux dans les DS aux venins d’hyménoptères ; on peut suggérer que les modifications observées dans les DS aux venins d’hyménoptères affectent des anti-IgE exerçant des effets pro-allergiques, telles celles interagissant avec le domaine Ce4, qui potentialisent la fixation et/ou le pontage des IgE sur la membrane des cellules effectrices. A l’inverse, il est possible que les modifications observées dans les DS aux pneumallergènes affectent des anti-IgE douées de propriétés anti-allergiques, telles celles interagissant avec les domaines (Ce2)-Ce3 des IgE ; en effet, ces anticorps inhibent la fixation des IgE sur les récepteurs de haute affinité, la libération d’histamine par les basophiles, le chimiotactisme leucocytaire, et la production des IgE in vitro et in vivo chez la souris, et in vitro chez l’homme.
- Modifications
portant sur les anticorps anti-idiotypiques : le taux des anticorps
anti-idiotypiques est augmenté dans le sérum des malades désensibilisés aux
pneumallergènes et aux venins d’hyménoptères. Outre un possible effet
inhibiteur sur la production des IgE, ces anticorps pourraient interagir avec
le F(ab’)2 des IgE fixées sur les membranes cellulaires, inhiber le pontage de
ces IgE, et, finalement, inhiber l’activation des cellules effectrices. Cette
hypothèse est étayée par les résultats d’études montrant que les anticorps
anti-idiotypiques du sérum d’apiculteurs non allergiques et de malades
désensibilisés à l’abeille peuvent se fixer sur des idiotypes exprimés sur les
IgE spécifiques et inhiber le RAST.
(b) Hypothèses
récentes (modifications portant sur le nombre et l'activabilité des cellules
effectrices) : de
nombreuses études ont montré que la DS inhibait significativement le nombre des
cellules effectrices dans le sang et les tissus : ainsi, chez les
asthmatiques désensibilisés au bouleau, le nombre des éosinophiles n’augmente,
ni dans le sang ni dans le liquide de lavage bronchoalvéolaire (LBA), pendant
la saison pollinique (Fig. 3), et le taux de l’histamine sanguine totale (qui
reflète le nombre des basophiles sanguins) est diminué chez les sujets
désensibilisés aux pollens. De plus, le nombre des mastocytes est
significativement diminué dans la muqueuse nasale des malades désensibilisés
pour rhinite allergique aux acariens, dès le troisième mois suivant le début de
la DS.
La
DS réduit également l’activabilité des cellules effectrices : ainsi, le taux
d’histamine plasmatique n’augmente pas, après une piqûre volontaire, chez les
malades désensibilisés avec succès aux venins d’hyménoptères ; par contre, chez
les malades chez lesquels la DS n’est pas efficace, la piqûre d’hyménop-tère
induit une augmentation considérable du taux plasmatique de l’histamine. Chez
les sujets désensibilisés aux pollens, le taux sérique d’ECP (eosinophil
cationic protein) n’augmente pas pendant la saison pollinique, et le taux du
PAF est significativement diminué dans le plasma des malades désensibilisés
pour allergie aux acariens de la poussière de maison. La DS induit également
une diminution significative de la libération d’histamine, de LTs et de PAF par
les leucocytes sanguins, de l’agrégation plaquettaire, et des propriétés
cytotoxiques des plaquettes et des cellules naturelles cytotoxiques ; elle
inhibe aussi la dégranulation des mastocytes de la muqueuse nasale chez les
sujets désensibilisés pour rhinite allergique (Fig. 4), et la libération
d’histamine dans la peau, après injection ID de l’allergène.
Enfin,
les résultats de travaux très récents ont montré que, in vitro, la production
(spontanée) de cytokines pro-inflammatoires non typiquement Th1 ou Th2, telles
l’IL-8, le MCP-1 et le RANTES par les cellules mononucléées sanguines était
très diminuée chez les sujets DS aux venins d’hyménoptères, et que, chez ces
mêmes sujets, il existait une diminution significative de la réactivité des
basophiles et des mastocytes au MCP-3 et au RANTES ; cette inhibition est liée
à une désensibilisation pharmacologique des récepteurs des basophiles et des
mastocytes pour ces chémokines, qui résulte d'une production initialement
accrue de RANTES par les pla-quettes.
Les
mécanismes responsables de cette diminution du nombre et de l’activabilité des
cellules effectrices de l’allergie ne sont pas encore parfaitement connus : les
hypothèses initiales ont fait appel aux modifications de la production des
anticorps évoquées plus haut. Cependant, de nombreux auteurs ont montré que la
diminution du taux des IgE sériques, l’augmentation du taux des IgG
spécifiques, et les modifications des taux des anti-IgE et des anticorps
anti-idiotypiques n’étaient pas significativement corrélées avec l’efficacité
de la DS ; ainsi, on peut penser que les modifications qui portent sur la
production des IgE, IgG, anti-IgE et anticorps anti-idiotypiques, ne sont pas
les principaux mécanismes responsables de l’efficacité clinique de la DS, et des
résultats récents suggèrent fortement que la diminution du nombre et de
l’activabilité des cellules effectrices, induite par la DS, résulte
essentiellement d’une modification portant sur le nombre et la réactivité des
sous-populations lymphocytaires (cf. infra).
(c) Hypothèses
actuelles (normalisation de la réactivité lymphocytaire) : des modifications diverses du
nombre et de la réactivité des lymphocytes ont été rapportées chez les sujets désensibilisés.
Ainsi, une augmentation transitoire du nombre des lymphocytes T (CD3), et une
réduction de la réactivité lymphocytaire in vitro, de la production
d’interleukine-2 (IL-2) et du récepteur soluble de l’IL-2 (sIL-2R), ont été
mises en évidence dans le sang des malades désensibilisés par des allergènes
divers. Par ailleurs, le taux sérique du sIL-2R est significativement diminué
chez les sujets désensibilisés avec succès. Bien qu’aucune modification
significative du rapport CD4/CD8 n’ait été objectivée dans le sang des malades
désensibilisés, non plus que dans la phase tardive de la réaction cutanée
induite par l’injection ID d’allergène, une induction et une activation de
lymphocytes T "helper" spécifiques a été rapportée dans le sang des
enfants désensibilisés aux venins d’hyménoptères, et corrélée avec
l’augmentation du taux sérique des IgG(4) spécifiques. De plus, la DS induit la
génération et l’activation de lymphocytes T "suppresseurs" (CD8+),
qui inhiberaient la production des IgE totales et spécifiques in vitro ;
toutefois, cette dernière notion est contestée par certains auteurs.
Des résultats, publiés récemment, montrent clairement que la DS induit une normalisation de la réponse Th1/Th2 aux allergènes, avec une réorientation vers une réponse du type Th1 : c'est ainsi que, après activation in vitro par les allergènes, les cellules mononucléées sanguines des malades désensibilisés à des allergènes divers produisent significativement moins d’IL-4 et d’IL-5, et plus d'IFN-g qu'avant la DS (Fig. 6). In situ, ont également été rapportées une diminution de l’expression des ARN messagers (mARN) pour l’IL-4 et l'IL-5, et une augmentation de l’expression des mARN pour l’IL-12, l'IL-2 et l’IFN-g. Ainsi, la DS diminue la réponse Th2 et augmente la réponse Th1 aux allergènes. Ces modifications, qui se produisent très rapidement chez les sujets désensibilisés selon une méthode accélérée, et plus lentement dans les DS conventionnelles, pourraient être à l’origine d’une réduction de l’expression du CD23/FceRII sur les lymphocytes B et dans le sérum, et, secondairement, d’une diminution de la production des IgE, ainsi que d’une augmentation de la production des IgG(4), de la diminution du nombre et de l’activabilité des cellules effectrices, et, en fin de compte, de la diminution de la réactivité aux allergènes.
Finalement,
in vitro, les cellules mononucléées sanguines des malades désensibilisés
produisent des cytokines douées de propriétés anti-allergiques et
anti-inflammatoires, telles l’IL-10 (Fig. 7), le HRIF (histamine
release-inhibitory factor), et le PASL (platelet activity-suppressive cytokine)
: les sous-populations cellulaires susceptibles de produire ces dernières
cytokines n'ont pas encore été clairement identifiées, mais on peut suggérer
qu'il s'agit de lymphocytes CD4 ou CD8 du type Th1, comme cela a été démontré
pour l'IL-10.
Efficacité de la désensibilisation : les résultats les meilleurs sont
obtenus chez l'enfant, l'adolescent et l'adulte jeune mono- ou
pauci-sensibilisés ; ils sont moins bons lorsqu'il existe une
polysensibilisation, et lorsque l'allergie est intriquée avec des causes non
allergiques (sujets âgés notamment).
En
pratique courante, l'efficacité de la désensibi-lisation doit être appréciée
essentiellement sur des critères cliniques (modification de la symptomatologie,
et diminution de la consommation médicamenteuse). Les autres critères sont
secondaires, si l'efficacité clinique est bonne :
- diminution
de la réactivité cutanée, inconstante, et n'apparaissant généralement que
tardivement ;
- diminution
de la réactivité des organes et des tissus-cibles, lors des tests de
provocation spécifiques, qui porte surtout sur la phase tardive ;
- diminution
des taux des IgE sériques totales, et surtout spécifiques ;
- augmentation
du taux des IgG (4 notamment) spécifiques.
En
milieu spécialisé, l'efficacité de la DS pourra être appréciée sur les réponses
aux tests d'activation cellulaire (TDBH, tests de l'histamine-release ou de la
production des LTs, etc.), sur la numération des cellules effectrices
(mastocytes, basophiles, éosinophiles, lymphocytes) et les dosages des
médiateurs ou des cytokines dans les secrétions ou dans les muqueuses, sur les
tests de prolifération lymphocytaire, et, éventuellement, sur l'étude de la
réactivité des sous-populations lymphocytaires. Il s'agit là de méthodes
lourdes et coûteuses, qui, en fait, n'ont d'intérêt qu'en matière de recherche,
pour essayer de préciser les mécanismes de la désensibilisation.
Le
plus souvent, la décision d'arrêter la DS est facile à prendre, après 3 à 5
ans, sur une association plus ou moins complète des critères d'efficacité, et
notamment sur l'efficacité clinique.
Incidents et accidents de la désensibilisation : il s'agit le plus souvent de
réactions locales, banales et aisément contrôlées par les antihistaminiques.
Peuvent également être observées, mais plus rarement, des réactions
granulomateuses, caractérisées par la formation de nodules sous-cutanés, qui se
voient plus souvent avec les extraits retard (adsorbés sur hydroxyde
d'aluminium) ; les réactions à type de phénomène d'Arthus sont exceptionnelles,
en particulier chez l'enfant.
Les
réactions générales, notamment sévères (chocs anaphylactiques a minima ou
potentiellement mortels) sont exceptionnelles (moins de une ou 2 p.mille
injections), alors que les réactions syndromiques ne sont pas rares : elles
surviennent essentiellement en cas de surdosage. Le risque de survenue de
telles réactions impose de surveiller le malade pendant au moins 30 mn après
l'injection d'extrait allergénique.
III - Aspects cliniques de l'allergie immediate
A - Allergie respiratoire &
oculaire
Introduction : avec la dermatite atopique, les manifestations respiratoires sont
les manifestations les plus fréquentes de l'allergie immédiate. Ces manifestations
allergiques peuvent être gênantes (par leur répétition qui entrave les
activités du malade), sévères (certains asthmes, kérato-conjonctivites), et
potentiellement fatales (oedème de Quincke avec extension laryngée, crises
d'asthme hypersévères). Les allergènes de l'allergie respiratoire et oculaire
sont avant tout les aéro-allergènes (poussières, de maison notamment, avec ses
acariens, ses allergènes de blatte et/ou d'animaux domestiques ; pollens et
moisissures ; allergènes professionnels volatils divers).
Au
niveau du nez, les allergies respiratoires se traduisent par des rhinites,
associant plus ou moins complètement prurit nasal, rhinorrhée, et obstruction
nasale ; y sont souvent associés des signes oculaires (rhinoconjonctivite) et
sinusiens (céphalées et fatigue), et, dans 5 à 10 % des cas, une toux
spasmodique et/ou un asthme. Selon leur caractère permanent ou épisodique, on
distingue les rhinites et rhinosinusites perenniales (essentiellement dues aux
acariens, blattes, moisissures domestiques, animaux domestiques et allergènes
professionnels), et les rhinites saisonnières (surtout dues aux pollens et aux
moisissures atmosphériques).
L'allergie
immédiate est sans conteste la plus fréquente cause d’asthme (asthme
"extrinsèque", par opposition à l'asthme dit "intrinsèque",
dont les facteurs étiologiques sont moins faciles à appréhender).
Cliniquement,
l'asthme se manifeste comme une dyspnée paroxystique sifflante, à prédominance
expiratoire, et régressant spontanément ou sous l'influence des
bronchodilatateurs. Au plan fonctionnel, l'asthme est caractérisé, d'une part
par un syndrome obstructif, et d'autre part par une hyperréactivité bronchique
(HRB). Enfin, au plan anatomopathologique, on observe, à des degrés divers : un
bronchospasme, un oedème de la muqueuse bronchique, une augmentation de la
sécrétion et de la viscosité du mucus bronchique, et une fréquente désquamation
de l'épithélium bronchique ; dans les formes sévères et évolutives, peuvent
être observées une hypertrophie du muscle lisse bronchique et des glandes
bronchiques, et une importante infiltration de la paroi bronchique par des
éosinophiles.
Ces
divers phénomènes résultent de mécanismes complexes et intriqués, comportant à
la fois des anomalies du contrôle neurologique de la bronchomotricité
(hyperréactivité des systèmes para-sympathique et NANC bronchoconstricteurs ;
diminution de la sensibilité des récepteurs bêta-
adrénergiques
bronchorelaxants), et des anomalies résultant de la production exagérée de
médiateurs et cytokines vaso-actifs, bronchoconstricteurs et
pro-inflammatoires.
Les
examens paracliniques permettent, d'une part de confirmer le diagnostic, et,
d'autre part, d'évaluer la sévérité de l'asthme :
- la
radiographie thoracique est généralement normale en dehors des crises, sauf
dans les asthmes sévères et insuffisamment traités, évoluant depuis plusieurs
mois ou années. Lorsqu'elle est effectuée pendant une crise, elle montre une
distension thoracique (horizontalisation des côtes, élargissement des espaces inter-costaux,
abaissement et aplatissement des coupoles diaphragmatiques, et hyperclarté du
parenchyme pulmonaire, sur les clichés de face ; augmentation du diamètre
antéro-postérieur du thorax, avec espace clair rétrosternal, sur le cliché de
profil gauche) ; toujours en crise, elle peut également montrer une atélectasie
ou un emphysème localisé (secondaires à une obstruction bronchique complète),
un pneumothorax ou un pneumomédiastin (soit conséquences, soit causes de la
crise) ;
- les
explorations fonctionnelles respiratoires (EFR) : elles sont généralement
impraticables au moment de la crise, à l'exception de la mesure du DEP (débit
expiratoire de pointe), qui est significativement abaissé. Effectuées à
distance des crises, les EFR sont normales dans les asthmes bénins et
modérément sévères ; le diagnostic repose alors sur les tests de provocation
bronchique, qui consistent à faire respirer au sujet des substances
bronchoconstrictrices (histamine, métacholine, etc.), et à déterminer son seuil
de sensibilité à ces substances. Chez les asthmatiques sévères, les EFR mettent
en évidence une obstruction, plus ou moins réversible sous bronchodilatateurs ;
- enfin,
l'étude des gaz sanguins, du pH sanguin et de l'équilibre acidobasique n'est indiquée
que dans les asthmes sévères : une hypoxie, une hypercapnie et une acidose
représentent des signes de sévérité, et imposent une hospitalisation.
Le
diagnostic d'asthme ne devra être retenu qu'après avoir éliminé un certain
nombre de diagnostics différentiels : chez l'adulte, il s'agit notamment des
dyspnées laryngées, de l'oedème aigu du poumon, de l'inhalation d'un corps
étranger, d'une obstruction ou d'une compression bronchique par des
adénopathies, une tumeur, un kyste bronchogénique, etc. Chez l'enfant, il faut
évoquer des causes obstructives diverses (corps étranger, sténose bronchique,
malformation, tumeur, adénopathies bénignes ou malignes, arcs vasculaires
anormaux), une trachéobronchomalacie, un reflux gastrooesophagien (RGO), des
troubles de la déglutition, une mucoviscidose, des séquelles de pneumopathie
virale, une dilatation bronchique, etc... Chez le nourrisson, enfin, de
nombreuses affections autres que l'asthme peuvent être à l'origine d'une
inflammation bronchique et bronchiolaire, avec obstruction et wheezing, voire
majorer un asthme authentique ; la longue liste de ces affections justifie la
pratique d'un bilan systématique complet (cf. Tableau I) ; au terme de ce
bilan, une bronchoscopie sera effectuée lorsqu'aucun diagnostic précis ne sera
évoqué, ou lorsque seront évoqués certains diagnostics particuliers (inhalation
de corps étranger, bronchodysplasie, trachéomalacie/dyskinésie
trachéo-bronchique, etc...).
Le
diagnostic étiologique des rhinites et rhino-conjonctivites allergiques et de
l'asthme repose usuel-lement sur les données fournies par l'interrogatoire, et
sur les résultats des TC à lecture immédiate, et, éventuellement, des RAST. Des
tests de provocation (bronchique ou nasale) spécifiques peuvent être effectués
lorsque les résultats des TC et/ou des RAST laissent persister un doute.
Le traitement curatif des rhinites repose sur les médicaments symptômatiques (antihistaminiques locaux et/ou per os ; antidégranulants locaux ; corticoïdes locaux, per os, voire retard injectables), en fonction de la sévérité des symptômes. Le traitement symptômatique de l'asthme repose sur une association plus ou moins complète de trois grandes catégories de médicaments : les bronchodilatateurs (théophyllines per os et injectables ; b2-adrénergiques inhalés, per os ou injectables), les anti-dégranulants/anti-inflammatoires non stéroïdiens inhalés (cromoglycate, nédocromil), et les corticoïdes inhalés, per os, ou injectables. Il doit être adapté en fonction de la sévérité de la maladie asthmatique. Selon un consensus international récent :
- le
traitement des asthmes bénins et épisodiques, sans HRB, repose sur les
bronchodilatateurs inhalés ou per os, donnés de façon ponctuelle, lors des
crises ;
- les
asthmes modérés requièrent un traitement de fond par les
antidégranulants/anti-inflammatoires inhalés, auxquels sont ajoutés des
bronchodilatateurs inhalés ou per os à la demande ;
- enfin,
les asthmes sévères, avec obstruction intercritique, nécessitent un traitement
de fond par corticoïdes inhalés et bronchodilatateurs inhalés à longue durée
d’action, auxquels sont ajoutés des bronchodilatateurs inhalés à courte durée
d’action, à la demande.
D'une
façon générale, la prévention des récidives ou de la perennisation de l’asthme
et de la rhinite allergiques repose sur l'association plus ou moins complète
d'un certain nombre de mesures :
- une
éviction des facteurs déclenchants, allergéniques ou non (tabagisme ; retrait
d'une crèche collective, où le risque d'infections ORL est élevé ; hygiène de
la literie ; éviction des animaux domestiques ; etc......), dans la mesure du
possible ;
- la
désensibilisation, dans les formes modérées, bien équilibrées par le traitement
médicamenteux.
Les
traitements symptômatiques bien conduits, éventuellement associés à une
désensibilisation, donnent généralement de bons résultats chez les sujets
jeunes et sensibilisés à un nombre limité d'allergènes ; schématiquement, on
peut espérer une guérison dans la moitié des cas, une amélioration dans 25 %
des cas, et une absence d'amélioration, voire une aggravation, dans le quart
des cas restant.
En
revanche, dans l'asthme "vieilli", où les crises perdent leur
caractère aigu et où il existe souvent une polysensibilisation, le traitement
est difficile et ses résultats sont souvent décevants. A plus ou moins long
terme, deux types de complications graves peuvent survenir : un état de mal
asthmatique (crise aiguë sévère), et un asthme à dyspnée continue, majorée par
les efforts physiques, les expositions aux allergènes, et les expositions aux
irritants respiratoires. Les surinfections sont fréquentes, et l'évolution
habituelle se fait vers une insuffisance cardio-respiratoire chronique.
B - Manifestations cutanées de l'HSI
1)
La dermatite atopique
La dermatite atopique (DA), ou eczéma constitutionnel,
touche 2,5 à 5 % des individus, selon les auteurs ; il s'agit d'une
affection récidivante et chronique, qui affecte essentiellement le nourrisson
et le jeune enfant, mais qui peut aussi toucher le grand enfant, l'adolescent
et l'adulte.
Les
mécanismes immunopathogéniques en cause restent encore incomplètement connus ;
en effet, la DA associe des anomalies relevant à la fois :
- d'une
HSR (aspect clinique et histologique des lésions, fréquente positivité des
patch-tests aux trophallergènes ou/et aux pneumallergènes courants) ;
- d'une
HSI (antécédents familiaux d'atopie ; taux élevé des IgE sériques ; présence
d'IgE sur les mastocytes du derme et les cellules de Langerhans de l'épiderme ;
positivité des TC à lecture immédiate dans 70 à 80 % des cas ; évolution
fréquente vers une allergie respiratoire).
Aspects cliniques : les lésions, très prurigineuses, débutent par des plaques
érythémateuses et oedémaciées qui évoluent, à des degrés variables, vers la
vésiculation et le suintement ; l'évolution se fait par poussées, entrecoupées
de périodes de rémission, souvent incomplète. A un stade plus tardif on observe
des érosions par désquamation, et une lichénification circonscrite.
Classiquement,
la DA débute avant l'âge de 1 an (le plus souvent vers 3 ou 4 mois, mais
parfois plus tôt) : les lésions prédominent alors aux zones convexes (joues et
menton, en épargnant le nez ; cuir chevelu ; faces d'extension des membres) ;
dans les formes sévères, une extension au tronc et au siège, voire aux plis,
est fréquente. Une rémission spontanée se produit dans environ 50 % des cas,
entre l'âge de 10 ans et la puberté. Chez l'enfant plus grand, l'adolescent et
l'adulte, les lésions touchent préférentiellement les plis (creux poplité, pli
du coude, nuque, sillon rétro-auriculaire), ainsi que, assez souvent, le dessus
des mains.
D'autres
signes cliniques (dits "mineurs") peuvent aider au diagnostic : une
xérose (sécheresse de la peau) et une kératose pilaire, très fréquentes ; une
pâleur (faciale notamment), contrastant avec la pigmentation du repli
sous-palpébral inférieur (signe de Dennie-Morgan) ; une cheilite de la région
péribuccale.
Les
principales complications de la DA sont :
- les
surinfections : les surinfections bactériennes (staphylococciques
notamment) sont fréquentes ; elles se développent sur les vésicules rompues
spontanément ou par grattage. Une surinfection herpétique doit être évoquée sur
l'aspect bien limité, creusant et érosif, voire nécrotique, des lésions, et
impose un traitement anti-viral par Zovirax®, de façon à prévenir la formation
de bulles géantes, par confluence des lésions (syndrome de Kaposi-Juliusberg) ;
- une
lichénification de la peau : elle se constitue progressivement, et est
d'autant plus marquée que les poussées de DA sont fréquentes et sévères.
- une
cataracte : c'est une complication rare, observée chez quelques rares
malades atteints de DA chronique sévère.
Traitement et prévention : le traitement est essentiellement symptômatique. Il
repose sur divers types de mesures, plus ou moins associées :
- la
lutte contre la xérose, en peau non lésée : elle est assurée par les émollients
(crèmes ou huiles de bain) ou/ et les kératolytiques (Xéroderm®, etc.). Il est également
souhaitable d'assurer une bonne hydratation générale (boisson), et une
humidification de l'atmosphère ; enfin, il est conseillé d'éviter les bains
trop chauds et trop longs, qui favorisent le déssèchement de la peau
- une
antiseptie soigneuse, basée sur l'utilisation quotidienne de savons
antiseptiques. En cas de surinfection, on pourra être amené à prescrire une
antibiothérapie locale. Lorsque la surinfection est majeure, il faudra avoir
recours aux antibiotiques antistaphylococciques per os ;
- la
lutte contre le prurit, par l'administration d'antihistaminiques H1. Toutefois,
ces médicaments ne sont pas toujours efficaces aux doses pharmacologiques
usuelles ;
- la
corticothérapie locale, lors des poussées : selon la sévérité, on aura recours
à l'application, sur les lésions, de crèmes dermocorticoïdes de niveau 1 (le
plus faible), de niveau 2 ou 3, voire de niveau 4 (le plus fort ). La
corticothérapie par voie générale est formellement contre-indiquée : en effet,
si elle induit une amélioration clinique rapide, elle est généralement
responsable d'un phénomène de rebond préjudiciable après l'arrèt, même
progressif, du traitement.
- dans
les formes très sévères, on peut être amené à prescrire de la cyclosporine, mais
seulement en milieu hospitalier.
En
ce qui concerne la prévention, la fréquence et la sévérité des récidives
peuvent souvent être diminuées grâce à certaines mesures relativement simples :
- une
lutte quotidienne contre la xérose, par les émollients et l'humidification de
l'atmosphère ;
- une
antiseptie cutanée quotidienne, basée sur l'utilisation de savons liquides
antiseptiques
L'éviction
des allergènes, et notamment des trophallergènes, est très discutée, sauf dans
les cas particuliers d'allergie évidente à certains allergènes alimentaires
comme l'oeuf, le chocolat et les laitages, ou à certains aéro-allergènes
(acariens et animaux domestiques, notamment).
Enfin,
la désensibilisation donne parfois de bons résultats ; elle doit être menée
très précautionneusement, et avec des extraits aqueux exclusivement.
2)
Urticaires et oedèmes de Quincke
Il s'agit d'affections fréquentes, mais qui, bien souvent,
ne relèvent pas d'une allergie.
Description clinique : la lésion élémentaire d'urticaire est une papule
oedémateuse, qui résulte de l'extravasation de liquide dans le derme
superficiel ; les lésions sont de taille variable, roses ou rouges, avec un
fréquent pâlissement progressif de la région centrale. Elles sont
prurigineuses, fugaces et migratrices.
L'oedème de Quincke, quant à lui, résulte d'une localisation profonde,
hypodermique ou sous-muqueuse, de l'oedème ; il peut être isolé ou associé à
une urticaire. De survenue brutale, sous la forme d'un oedème blanchâtre ou
rosé, il est peu prurigineux, mais comporte souvent une sensation de tension ou
de cuisson. Il se localise avec prédilection aux lèvres, à la langue, aux
paupières, au pharynx et aux organes génitaux externes ; la localisation au
larynx, avec oedème de la glotte, peut mettre en jeu le pronostic vital, et
impose un traitement d'urgence. Une modification de la voix (raucité) et/ou une
dysphagie représentent des signe d'alarme d'extension laryngée.
L'oedème
de Quincke doit être différencié de l'oedème angio-neurotique héréditaire
(OANH), qui lui ressemble cliniquement, mais qui résulte d'un déficit
congénital en inhibiteur de la C1-estérase, et dont les aspects cliniques, les
mécanismes et le traitement sont évoqués dans un autre chapitre.
Physiopathologie : les urticaires et oedèmes de Quincke résultent de la
dégranulation des mastocytes tissulaires, avec libération de substances
vasodilatatrices et vasoperméatrices. Divers mécanismes peuvent être en cause :
- dépendants
des IgE (allergie immédiate, anaphylaxie) ;
- médiés
par des facteurs du complément activé (C-kinines et anaphylatoxines) ;
- non
immunologiques, liés à des substances ou agents directement
histamino-libérateurs, ou bien riches en histamine.
Etiologies : on distingue les urticaires et oedèmes de Quincke aigus et
chroniques, dont les étiologies sont en grande partie distinctes.
Le
diagnostic étiologique des formes aiguës est généralement aisé à
effectuer par le seul interrogatoire : les substances en cause sont
essentiellement des médicaments ou des aliments (cf. chap. correspondants). Les
autres causes, moins fréquentes, sont les maladies virales (phase prodromique
de l'hépatite virale, mononucléose infectieuse, virus divers), les parasitoses
(helminthiases : ténias, ascaris, distomatose, kyste hydatique, etc.), les
contacts avec des animaux ou des végétaux urticants (orties, méduses, chenilles
processionnaires, etc.), et les piqûres d'insectes (hyménoptères notamment).
On
définit une urticaire chronique comme une urticaire évoluant par
poussées depuis au moins 6 semaines. On distingue :
- les
urticaires physiques, probablement les plus fréquentes (cf. Tableau II)
: il s'agit avant tout du dermographisme, qui peut être très invalidant.
D'autres formes, plus rares, sont décrites : l'urticaire à la pression, à la
chaleur et au froid, l'urticaire cholinergique, les urticaires aquagénique et
solaire ;
- les
urticaires de cause systémique, non exceptionnelles, où les lésions sont
chroniques et fixes, peu prurigineuses, et souvent associées à des
manifestations générales (fièvre, arthralgies, syndrome inflammatoire). Les
affections en cause sont nombreuses (cf. Tableau III) ;
- les
urticaires dites "communes" : lorsque leur cause est retrouvée,
il s'agit le plus souvent de médicaments (bêtalactamines et antiinflammatoires
non stéroidiens notamment), d'aliments ou d'additifs alimentaires. Toutefois,
dans près de 70 % des cas, leur étiologie ne peut être déterminée.
Bilan diagnostique : une fois reconnu, par l'interrogatoire ou/et l'examen
clinique, le diagnostic positif d'urticaire ou d'oedème de Quincke, le bilan
étiologique a pour but de déterminer l'agent responsable :
- dans
les formes aiguës, le plus souvent l'interrogatoire seul suffit. Selon le
contexte, des examens complémentaires seront demandés : NFS, à la recherche
d'une éosinophilie sanguine ; examen parasitologique des selles et scotch test
; dosage des transaminases ; bilan allergologique, si l'on soupçonne un aliment
ou un médicament.
- dans
les formes chroniques, si l'on soupçonne une cause physique, le diagnostic étiologique
repose sur des tests simples : recherche d'un dermographisme, tests au glaçon
(urticaires au froid), au poids (urticaire retardée à la pression), à l'eau
(urticaire aquagénique), tests photobiologiques (urticaire solaire), etc. Ces
tests, qui sont bien standardisés, doivent être effectués par des médecins
compétents et, de préférence en milieu hospitalier (risque de réaction
anaphylactique sévère).
En
l'absence d'élément d'orientation, sera demandé un bilan complet, comportant :
NFS et VS, dosage des IgE sériques totales, électrophorèse des protides, voire
immunoélectrophorèse, bilan hépatique, recherche de protéinurie et examen
cytobactériologique des urines, radiographies de thorax, des sinus, et
panoramique dentaire, sérologie HBs, toxoplasmose et MNI-test, dosages du
complément hémolytique et des facteurs C3 et C4, enfin, bilan allergologique
(aliments, médicaments, hypersensibilité microbienne ou fongique). Au moindre
doute, on demandera un dosage des anticorps antinucléaires et des hormones thyroïdiennes.
La biopsie cutanée, avec examen histologique et en immunofluorescence, n'est
indiquée que lorsqu'on soupçonne une vascularite urticarienne.
Traitement :
- Traitements
symptomatiques : les antihistaminiques H1 présentent avant tout un intérêt préventif
; ils doivent être prescrits per os à dose suffisante et de façon prolongée. Il
faut proscrire formellement l'emploi des pommades anti-H1, car elles sont peu
efficaces, et sont responsables d'eczémas de contact dans un nombre non
négligeable de cas. L'Hypostamine® (inhibiteur de la synthèse de
l'histamine) est peu utilisée ; elle doit être administrée de façon
prolongée (plusieurs mois), et son efficacité est inconstante.
Le
Nalcron® (antidégranulant per os) pourraît présenter un certain intérêt dans
les urticaires d'origine alimentaire.
Les
antiinflammatoires non stéroïdiens (indométacine en particulier) sont réservés
aux urticaires retardées à la pression.
L'indication
des corticoïdes par voie générale est limitée aux angio-oedèmes avec
localisations pharyngo-laryngées, aux urticaires avec manifestations
anaphylactiques sévères, à la maladie sérique, aux formes sévères des
vascularites urticariennes, et aux urticaires retardées à la pression résistant
aux antiinflammatoires non stéroïdiens.
Enfin,
les bêtastimulants sont indiqués sous forme d'adrénaline en spray
(Dyspne-Inhal® : 1 à 2 bouffées) en cas d'oedème de Quincke laryngé, ou bien
sous forme injectable (Adrénaline au 1/1000e du Codex : 0,25 à 1 ml en SC, IM
ou IV lent) ou per os (solution aqueuse au 1/1000e), en cas d'urticaires
s'accompagnant de manifestations anaphylactiques sévères.
- Traitement
étiologique : lorsqu'une étiologie a été retrouvée, il est bien entendu indispensable
(éviction d'un allergène, voire désensibilisation dans le cas des allergies aux
venins d'hyménoptères ; traitement d'un foyer infectieux bactérien ou fongique,
d'une parasitose, etc).
C - Allergie alimentaire
Introduction : sur la base des enquêtes effectuées par questionnaires, on estime
que la prévalence de l'allergie alimentaire se situe entre 10 et 24 %, dans les
pays occidentaux. Cependant, cette fréquence est certainement très surestimée ;
en effet la fréquence des fausses allergies alimentaires, dues à des aliments
histaminolibérateurs (alcool, fraises, crustacés, etc.) ou riches en amines
vaso-actives ou de putréfaction (boissons et aliments fermentés, gibier,
charcuterie, nombreux poissons, chocolat, etc.) est très élevée. De plus, certaines
réactions attribuées aux aliments sont en réalité imputables à des additifs
divers (colorants et conservateurs notamment), et, dans la plupart des cas,
relèvent de mécanismes non immunologiques (activation vagale, inhibition de la
cyclo-oxygénase, inactivation de l'histaminase, etc.).
Les
manifestations d'allergie alimentaire liées à une HS immédiate sont les plus
faciles à reconnaître dans la mesure où, dans la plupart des cas, les symptômes
surviennent rapidement après l'ingestion du (des) aliment(s) déclenchant(s).
Les symptômes peuvent être digestifs (oedème et prurit des lèvres et/ou de
l'oro-pharynx, nausées et vomissements, diarrhée) ; le plus souvent, il s'agit
de symptômes extradigestifs, généralement cutanés (urticaire et/ou oedème de
Quincke, voire exacerbation de DA), parfois respiratoires (rhinite, asthme) ou
plus généraux (malaise, choc). Les principaux aliments en cause sont le lait de
vache, l'oeuf, l'arachide (cacahuète), les poissons et fruits de mer, et de
nombreux légumes et fruits ; certains d'entre eux présentent une allergénicité
croisée avec d'autres aliments, généralement de la même famille ou de familles
voisines, ou avec des antigènes non alimentaires comme les pollens.
Les
allergies alimentaires d'apparition précoce (lait, soja, farine et oeuf,
notamment), guérissent avant l'âge de 3 ou 4 ans dans environ les deux tiers
des cas ; toutefois, elles reflètent l'existence d'un terrain atopique sévère,
et évoluent très souvent vers une allergie respiratoire et/ou vers une allergie
à d'autres aliments au cours des années suivantes. Par contre, les allergies
alimentaires d'apparition plus tardive (viandes, poissons, crustacés et
coquillages, fruits et légumes) ne guérissent que rarement, et le développement
progressif d'une allergie à un nombre croissant d'aliments est courant.
Les
manifestations d'allergie alimentaire non liées aux IgE sont plus difficiles à
diagnostiquer : il s'agit essentiellement de manifestations digestives
(diarrhée pâteuse ou grumeleuse, ballonnements abdominaux), qui apparaissent
avec retard après la consommation de l'aliment déclenchant, et présentent un
caractère subaigu ou chronique, susceptible d'évoluer vers une malnutrition et
un retard de croissance lorsque l'aliment continue à être consommé. Les deux principales
affections en cause sont la gastroentéropathie "aiguë" au lait de
vache ou de soja, et l'entéropathie au gluten (maladie coeliaque).
En
ce qui concerne le diagnostic de l'allergie alimentaire, deux situations sont
possibles :
- le
diagnostic est (pratiquement) évident : c'est le cas dans la plupart des
allergies liées à une HSI, où les manifestations cliniques surviennent en
général rapidement après l'ingestion de l'aliment déclenchant, le plus souvent
identifié par le malade lui-même ou son entourage, et où le bilan diagnostique
(TC à lecture immédiate, effectués avec des extraits allergéniques ou les
aliments frais ; RASTs ; épreuves d'exclusion-réintroduction et tests de
provocation labial ou oral, éventuellement) ne sert généralement qu'à confirmer
le diagnostic ;
- le
diagnostic est complexe (alimentation diversifiée, retard d'apparition des
symptômes, variabilité des troubles d'une fois à l'autre, etc.) : dans ce cas,
l'identification du (des) aliment(s) ou additif(s) en cause repose sur une
enquête "policière" comportant : un interrogatoire soigneux,
éventuellement orienté par les données fournies par un journal alimentaire ;
des épreuves d'exclusion-réintroduction, à partir d'un régime hypoallergénique
de base, les autres aliments étant réintroduits un par un tous les 3 à 4
jours ; des tests de provocation per os, de préférence en
double-aveugle contre placebo, sur la base des renseignements fournis par
l'interrogatoire, le journal alimentaire, et les épreuves d'exclusion-réintroduction.
Ces tests de provocation ne peuvent être effectués qu'en milieu hospitalier, et
sont en principe contre-indiqués chez les malades ayant présenté des réactions
anaphylactiques ou anaphylactoïdes sévères ; éventuellement, une biopsie
jéjunale, à la recherche d'une éosinophilie de la muqueuse digestive
(gastro-entérite à éosinophiles) ou d'une atrophie villositaire (entéropathie
au gluten), et des tests in vitro, qui permettent d'explorer l'HSR (tests de
prolifération lymphocytaire et d'inhibition de la migration leucocytaire) ou
l'HS semi-retardée (recherche d'anticorps précipitants anti-aliments) ; ces
derniers tests ne sont effectués que dans certains services très spécialisés,
et ne sont pas applicables en pratique courante, d'autant que leur valeur diagnostique
est loin d'être parfaite.
La
prévention des récidives repose sur :
- l'éviction
du (des) aliment(s) en cause ; cette mesure n'est pas toujours aisée à
appliquer lorsqu'il s'agit d'allergènes susceptibles d'être retrouvés, sous
forme masquée, dans d'autres aliments. Dans les allergies au lait de vache, ce
dernier peut être remplacé par des hydrolysats poussés de caséines,, les
hydrolysats de protéines, et le lait de soja ;
- le
Nalcron® : dans l'ensemble, il donne de bons résultats et facilite la réintroduction,
après une ou plusieurs année(s), du (des) aliment(s) non toléré(s) (lait, oeuf
et farine, notamment). Toutefois, le Nalcron® n'est efficace que dans les
allergies alimentaires liées à une HSI ;
- la
désensibilisation/accoutumance : réalisée par voie buccale, en milieu
hospitalier, et de façon très précautionneuse, elle a permis la réintroduction
du lait de vache et de l'oeuf chez un certain nombre de malades. Pour les
autres aliments, elle s'est jusqu'à présent révélée inefficace, voire dangereuse.
La
prévention générale de l'allergie alimentaire, quant à elle, est à
réserver aux nouveau-nés et aux nourrissons à risque élevé (antécédents
familiaux d'atopie, a fortiori d'allergie alimentaire ; taux élevé d'IgE dans
le sang de cordon). Elle repose sur les trois mesures suivantes :
- l'éviction
maternelle des aliments les plus allergisants pendant la fin de la grossesse et
la période d'allaitement ;
- une
prolongation de l'allaitement maternel jusqu'au 6e mois, si possible ; à
défaut, on utilisera des laits hypoallergéniques, des préparations à base de
soja, des hydrolysats de protéines ou de caséines ;
- enfin,
un retard apporté à la diversification de l'alimentation sera repoussée (6e
mois,) et une grande progressivité de cette diversification.
D - Allergie aux venins d'hyménoptères
Introduction : en termes de sévérité, les réactions allergiques aux venins
d’hyménoptères peuvent aller d’une réaction locale importante à une réaction
généra-lisée sévère, parfois mortelle, en passant par des réac-tions
systémiques bénignes (cutanées pures) et modé-rées (urticaires et/ou
angio-oedèmes associés à des signes généraux, mais spontanément résolutives).
La
prévention des récidives repose essentiellement sur la DS, dont les indications
sont déterminées par :
- les
résultats du bilan allergologique (TC à lecture immédiate ± RASTs), qui
doit être franchement positif : en règle générale, le bilan est considéré comme
positif lorsqu’il existe un TC positif jusqu’à 1 mcg/ml en IDR, et lorsque
le dosage des IgE sériques spécifiques est positif (supérieur à
0,70 PRU/ml pour le RAST). Certaines équipes effectuent également des
tests de provocation réalistes, mais leur valeur diagnostique et prédictive, et
leur caractère éthique, sont controversés ;
- la
nature et la sévérité de la réaction initiale sont des facteurs importants à
prendre en compte, car la fréquence et la sévérité des récidives augmentent
avec la sévérité de la réaction initiale : chez les adultes dont le bilan
allergologique est positif, la DS est indiquée dans les réactions généralisées
sévères (stades III et IV de la classification de Mueller) ; les réactions
systémiques modérées, et notamment les urticaires et angio-oedèmes sans
extension laryngée, représentent une contre-indication relative, la DS n'étant
envisagée que lorsqu’il existe des facteurs de risque associés (exposition
importante, atopie, maladie cardio-vasculaire et/ou broncho-pulmonaire,
traitement anti-hypertenseur au long cours). Les autres réactions (locales
pures, même importantes ; systémiques mineures et atypiques), et les patients
dont les TC et/ou les RASTs sont négatifs, ne représentent pas une bonne
indication de la désensibilisation ;
- en
ce qui concerne les facteurs de risque associés, l'âge du patient est important
à prendre en compte dans la décision de désensibiliser ou non : en effet, la
majorité des réactions et des récidives sévères surviennent chez l'adulte, et
notamment chez le sujet âgé ; par contre, chez l'enfant, il existe une tendance
marquée à la "guérison" spontanée, en quelques mois ou années. Les
maladies chroniques sévères, cardiovasculaires et/ou bronchopulmonaires, et les
traitements antihypertenseurs au long cours, représentent un important facteur
de sévérité des réactions allergiques aux venins d’hyménoptères, les deux tiers
ou les trois quarts des décès par choc anaphylactique survenant chez des
patients ayant de tels antécédents. Le rôle de l’atopie en tant que facteur
prédisposant à l’allergie aux venins d’hyménoptères est discuté ; il semble, toutefois,
que l'atopie représente un certain facteur de risque, au moins pour les
réactions sévères. Enfin, parmi les autres facteurs de risque, on peut retenir
le risque d'exposition (apiculteurs et familles d'apiculteurs, notamment) et,
peut-être, le sexe (M).
Lorsque
la DS a été décidée, son efficacité est jugée sur une association plus ou moins
complète de plusieurs critères : tolérance des injections de venin ; diminution
de la réactivité cutanée, voire négativation des TC (25 à 75 % des cas, selon les
séries) ; modifications des taux des IgE et IgG(4) spécifiques ; enfin,
importance des réactions aux repiqûres accidentelles, voire même, pour certains
auteurs, aux TP réalistes. L'arrêt de la DS est généralement décidé sur
plusieurs paramètres : une association plus ou moins complète des critères
d'efficacité, une durée suffisamment longue de la DS (3 ans au minimum),
et une dose cumulée de venin injectée de plusieurs milliers de microgrammes.
E - Allergies aux médicaments et
substances biologiques
Introduction : les patients qui rapportent des réactions susceptibles d'évoquer
une allergie aux médicaments et substances biologiques (vaccins, sérums,
produits de contraste radiologiques, etc.) sont nombreux ; la fréquence de ces
réactions augmente avec l'âge (moins de 10 % avant 20 ans, et jusqu'à 35 %
après 60 ans), et est directement liée au nombre de traitements et de
médicaments prescrits.
Les
médicaments les plus fréquemment en cause sont les antibiotiques (ATB) (plus de
50 % des cas), et surtout les bêtalactamines, les sulfamides
anti-infectieux (10 à 20 %) et les médicaments appartenant au grand groupe des
antipyrétiques-antalgiques-aspirine et autres anti-inflammatoires non
stéroïdiens (AINS : 20 %) ; mais de multiples autres médicaments et substances
biologiques peuvent être responsables de réactions, parfois sévères, tels les
anesthésiques généraux, et surtout les curarisants (ou myorelaxants), le latex,
les produits de contraste, les anticoagulants, les hormones, les enzymes, les
vaccins et sérums, etc.
Il
faut cependant souligner plusieurs notions importantes :
- certaines
réactions ressemblant à une réaction allergique sont liées à une action
pharmacologique du médicament : c'est notamment le cas de la plupart des
réactions à l'aspirine et aux autres AINS, aux anesthésiques locaux et à
certains anesthésiques généraux (hypnotiques, narcotiques) ;
- en
particulier chez l'enfant et, à un moindre degré, chez l'adulte, de nombreuses
réactions d'aspect allergique sont la conséquence d’infections ayant motivé la
prescription de médicaments (ATB, sulfamides, antipyrétiques et AINS), et ne
sont pas liées à une allergie médicamenteuse ;
- enfin,
environ 1 % des réactions évoquant une allergie médicamenteuse sont liées à des
additifs présents dans certaines formes médicamenteuses, mais pas à la molécule
de médicament elle-même.
Ainsi,
20 à 30 % seulement des réactions d'aspect allergique attribuées aux
médicaments sont réellement liées à une hypersensibilité (HS) médicamenteuse.
Selon une fréquence décroissante, les types d'HS en cause sont :
- les
réactions d'HS immédiate, liées aux IgE (40 %) : les plus fréquentes sont les
réactions cutanées (prurit, urticaire et/ou oedème de Quincke). Viennent
ensuite les manifestations respiratoires (rhinite et/ou asthme), et, plus
rarement, les réactions très sévères, à type de choc anaphylactique. Les
médicaments responsables sont essentiellement les ATB (bêtalactamines surtout)
; viennent ensuite les myorelaxants et le latex, puis les sérums, les hormones
, etc. ;
- les
réactions d'HS retardée (près de 30 %), à type d'eczéma, de photodermatose (où
le médicament devient allergisant par exposition aux rayons UV solaires), ou
d’éruption maculo-papuleuse : les principaux médicaments responsables sont
certains ATB et les sulfamides anti-infectieux, les neuroleptiques,
antihistaminiques, anesthésiques locaux, et certains antiseptiques et
désinfectants ;
- les
réactions d'HS semi-retardée (2,5 %), avec, notamment, le phénomène d'Arthus,
la maladie sérique, les vascularites aux sulfamides et ATB (bêtalactamines
notamment), et certaines réactions (dites anaphylactoïdes) ressemblant à des
réactions anaphylactiques, mais non liées aux IgE ;
- enfin,
des réactions rares, dont les mécanismes sont encore mal connus : il s'agit des
toxidermies (potentiellement) sévères (syndromes de Stevens-Johnson et de
Lyell/nécro-épidermolyse toxique, surtout liés aux sulfamides, AINS,
bêtalactamines et barbituriques), de la pustulose exanthématique aiguë
généralisée (PEAG), et des pneumopathies "d'hypersensibilité",
imputables à de très nombreux médicaments (immuno-suppresseurs et
anticancéreux, ATB, sulfamides, cardiorégulateurs, etc.).
Les
médicaments peuvent aussi, mais rarement, être à l'origine de réactions d'HS un
peu particulières, que l'on ne peut pas qualifier d'allergiques à proprement
parler, et qui se traduisent par une cytopénie (diminution du nombre des
cellules sanguines : hématies, leucocytes, plaquettes) ; les médicaments les
plus souvent en cause sont les bêtalactamines, les régulateurs du rythme
cardiaque, et les AINS.
Toute réaction suspecte doit être
signalée au médecin qui, seul, pourra effectuer un diagnostic précis ou, à
défaut, orienter le patient vers un allergologue bien rodé à ces problèmes. Là
encore, il est important de souligner quelques notions importantes :
- le
patient doit se souvenir des divers médicaments auxquels il a été exposé avant,
pendant et après l'accident médicamenteux (y compris en cas d'auto-médication)
;
- chez
les patients rapportant des réactions répétées à des médicaments de familles
diverses, il faut éliminer une possible intolérance à des additifs par un
examen comparatif des fiches signalétiques des médicaments non tolérés et
tolérés, et, éventuellement, des TPO. Doit également être évoquée une
intolérance aux antipyrétiques et AINS, souvent associés aux anti-infectieux,
notamment chez l’enfant ;
- le
diagnostic de certaines allergies médicamenteuses peut être fait grâce à des TC
: les TC à lecture immédiate permettent d’explorer les réactions liées à des
IgE pour certains ATB (bêtalactamines en particulier), diverses hormones, les
vaccins, les myorelaxants, le latex, et certaines enzymes (chymopapaïne) ; les
TC à lecture retardée, présentent une bonne valeur diagnostique et prédictive
pour les eczémas de contact et les PEAG(patch-tests) et les photodermatoses
(photopatch-tests ou phototests après ingestion du médicament). Par contre, les
TC ne présentent aucune valeur dans les réactions liées à une intolérance au
médicament ;
- les
tests sanguins (dosage des anticorps anti-médicament, IgE notamment ; tests
d'activation des basophiles sanguins, etc.) ne présentent généralement pas plus
de valeur diagnostique que les TC, et ne sont qu'exceptionnellement
nécessaires.
Mis
à part le traitement immédiat, qui dépend de la nature et de la sévérité de la
réaction, la prévention des récidives repose avant tout sur l'exclusion du
médicament auquel le patient est allergique et des médicaments de la même
famille ; en effet, il n'existe pas, à proprement parler, de méthodes de
désensibilisation comparables à celles qui peuvent être pratiquées dans les
allergies respiratoires ou aux venins d'hyménoptères. Ainsi, lorsque cela est
possible, il faut recourir à des médicaments ou substances biologiques doués
des mêmes propriétés, mais appartenant à des familles différentes.
Toutefois,
dans les rares cas où la réintroduction du médicament ou de la substance
biologique est indispensable, elle peut parfois être effectuée à moindre risque
par une méthode d'accoutumance, qui consiste à administrer, sous surveillance
en milieu hospitalier, des doses tout d'abord très faibles, puis lentement
croissantes, du médicament ; cette méthode s'applique avant tout aux réactions
allergiques du type immédiat, et donc liées aux IgE, mais elle a aussi été
utilisée avec un certain succès dans d'autres types de réactions, en
particulier chez les patients intolérants à l'aspirine et aux AINS.
HYPERSENSIBILITE DE TYPE II (PAR
ANTICORPS CYTOTOXIQUES)
I - Introduction
Les réactions d'hypersensibilité cytotoxique (ou HS de
type II) sont dues à des anticorps (IgM, IgG) qui se fixent sur les antigènes
de la membrane des cellules ou des tissus cibles, dont ils induisent la
destruction en activant localement le système du complément. Les antigènes
impliqués dans ces réactions d'hypersensibilité peuvent être constitutifs de la
membrane cellulaire, comme dans le cas des cytopénies auto-immunes ou de la
maladie hémolytique du nouveau-né, ou adsorbés sur cette membrane, comme, par
exemple, dans le cas des anémies hémolytiques induites par la pénicilline et
les céphalosporines.
Deux
mécanismes, qui agissent généralement en synergie, sont susceptibles
d'expliquer la destruction des tissus ou des cellules cibles par les anticorps
cytotoxiques :
- la
formation du complexe lytique C5b-6,7,8,9, après que le système du complément
ait été activé par la voie directe (ou classique) depuis le facteur C1. Les
premiers signes de cytolyse apparaissent avant que le C9 n'ait été fixé et activé,
le complexe C5b-6,7,8 induisant déjà une dépolymérisation de la membrane des
cellules sur lesquelles il est fixé; la fixation additionnelle de six molécules
de C9 sur la membrane cellulaire, à proximité immédiate du complexe C5b-6,7,8,
induit la formation de "trous" dans la membrane, permettant ainsi une
entrée massive d'eau et de sodium dans la cellule, alors que le potassium et
les protéines intracellulaires en sont chassées;
-
la libération, dans le microenvironnement, de certains facteurs du complément
activé (C5a notamment), qui exercent des effets chimiotactiques et activateurs
(opsonisation) sur les cellules effectrices de l'immunité (polynucléaires
neutrophiles et cellules monomacrophagiques notamment). Ces cellules se fixent
alors, par leurs récepteurs pour le Fc des immunoglobulines et pour les
facteurs C3b et C3d du complément, sur les cellules sensibilisées par les
anticorps cytotoxiques et le complément, et les détruisent.
Physiologiquement,
les anticorps cytotoxiques jouent un rôle important dans certaines réactions de
défense anti-infectieuse (bactéries, virus) et anti-tumorale. Les réactions
d'HS cytotoxiques liées aux anticorps sont à l'origine des rejets accélérés
(sur-aigus) d'allogreffe; elles sont également responsables d'affections
pathologiques diverses, et notamment de certaines cytopénies d'origine
médicamenteuse ou non, et de certaines maladies auto-immunes (syndrome de
Goodpasture, pemphigus, pemphigoide bulleuse, etc...).
II - Réactions d’hypersensibilité de type
II dues aux médicaments
Les
réactions d'HS de type II dues aux médicaments sont à peu près les seules qui
intéressent les allergologues, les autres réactions d'HS cytotoxique
intéressant surtout les immunohématologistes (incompatibilité rhesus foetomaternelle,
anémies hémolytiques post-transfusionnelles) ou des services spécialisés
(maladies auto-immunes).
A -
Manifestations hématologiques
Ce sont elles qui sont les plus fréquentes et les plus
facilement identifiables. Elles se traduisent par une anémie, une leucopénie ou
une thrombopénie, selon que les cellules sanguines détruites sont des hématies,
des leucocytes ou des plaquettes.
1)
Les anémies hémolytiques
Les anémies hémolytiques (AH) induites par les médicaments
peuvent être classées en deux groupes distincts: les AH dues à des anticorps
anti-médicament, et celles dues à des auto-anticorps.
Les
AH induites par la pénicilline et les céphalosporines représentent
l'exemple-type des anémies hémolytiques liées à des anticorps anti-médicament.
Elles s'observent chez des sujets ayant reçu des doses très importantes de
pénicilline ou de céphalosporines. Certains métabolites de ces médicaments
(radicaux penicilloil ou cephalosporoil) se fixent sur les hématies et,
devenant ainsi immunogènes, induisent la synthèse d'anticorps cytotoxiques qui,
en retour, viennent se fixer sur les radicaux penicilloil ou cephalosporoil
adsorbés sur la membrane des hématies, dont ils induisent la lyse, soit en
activant le complément, et/ou, surtout, en favorisant leur captation par les
cellules réticulo-endothéliales du foie et de la rate (cf. Chap. Allergie
médicamenteuse).
Certains
médicaments comme l'a-methyl-DOPA (Aldomet*) peuvent
induire des anémies hémolytiques qui sont dues à des anticorps
anti-érythrocytaires (IgM et IgG anti-D). L'origine de ces anticorps résulte de
la modification des antigènes rhesus, induite par la fixation de l'Aldomet* sur
la membrane érythrocytaire, les anticorps élaborés étant capables de réagir de
façon croisée avec les antigènes rhesus natifs (normaux). Les AH induites par
l'Aldomet* ne touchent qu'environ 1 p.cent des sujets traités; elles
n'apparaîssent qu'après plusieurs mois de traitement, et persistent plusieurs
semaines après l'arrèt du médicament, du fait de la persistance des anticorps dans
la circulation sanguine (cf. Chap. Maladies auto-immunes).
2)
Les Thrombopénies
L'exemple-type des thrombopénies immuno-allergiques
d'origine médicamenteuse est le purpura au Sedormid* (médicament maintenant
retiré du commerce), ainsi que certains purpuras induits par la quinine ou la
quinidine, où les anticorps anti-médicament se fixent sur le médicament
lui-même adsorbé sur la membrane plaquettaire.
En
revanche, les thrombopénies induites par la pénicilline seraient dues à des
auto-anticorps dirigés contre certains antigènes de la membrane plaquettaire,
modifiés par la pénicilline.
1.3. Les leucopénies : la plupart
(neutropénies notamment) n'ont pas une origine immuno-allergique ;
cependant, certaines agranulocytoses et neutropénies pourraient être dues à des
anticorps anti-médicament se fixant sur les médicaments (phenylbutazone,
amidopyrine) eux-mêmes fixé sur la membrane des granulocytes.
Si
un mécanisme de type II explique bien certaines cytopénies d'origine
médicamenteuse, bon nombre d'entre elles résultent de l'adsorption, sur la
membrane des cellules sanguines, de complexes immuns constitués d'antigènes
médicamenteux et d'anticorps anti-médicament activant le complément. Ce dernier
mécanisme, qui se rapproche de l'HS de type III, a pu être impliqué dans les
anémies hémolytiques induites par la rifampycine, dans les agranulocytoses
induites par la céphalotine, et dans les thrombopénies induites par des
médicaments divers (aspirine, céphalotine, digitoxine, rifampicine,
sulfamethazine, etc...).
B - Manifestations diverses
la plupart des manifestations non hématologiques induites
par les médicaments sont dues à des réactions d'HS des types I, III (par
complexes immuns) ou IV (HS retardée). Certaines d'entre elles pourraient
cependant être liées à une HS de type II: ainsi, certaines néphropathies
intersticielles et tubulo-intersticielles induites par la pénicilline et les
céphalosporines seraient dues à des anticorps anti-médicament venant se fixer
sur les radicaux penicilloil ou cephalosporoil, eux-mêmes fixés sur certaines
protéines du tissu rénal (membrane basale notamment).
Nous
ne reparlerons pas ici des purpuras induits par certains médicaments, dans la
mesure où ils ne sont que l'expression cutanée d'une anomalie hématologique
(voir plus haut). Certaines autres manifestations cutanées, comme les érythèmes
pigmentés fixes à la phénolphtaléine, pourraient être liées à des anticorps
anti-médicament venant se fixer sur le médicament, lui-même fixé au niveau de
la peau.
Enfin,
on a détecté des anticorps anti-médicament dans le serum des patients atteints
d'ictères cholostatiques induits par la chlorpromazine. Cependant, le rôle
précis de ces anticorps est discuté ; en effet, il n'existe pas de corrélation
entre leur taux sérique et la sévérité de l'atteinte hépatique.
III – Réactions d’HS de type II non liées aux médicaments
A
– Manifestations hématologiques
1)
Anémies hémolytiques
L'exemple-type de l'anémie due à des anticorps
cytotoxiques est l'AH par incompatibilité rhesus foeto-maternelle. Au cours de
cette maladie, la mère (Rh-) est immunisée, en fin de grossesse, par des
hématies (Rh+) d'origine foetale; les anticorps ainsi produits sont tout
d'abord des IgM, puis, lors d'une grossesse hétérospécifique ultérieure, des
IgG qui traversent le placenta, et viennent se fixer sur les hématies du
foetus, dont elles induisent la destruction.
Des
accidents comparables peuvent être observés à la suite de transfusions
incompatibles. Ils surviennent généralement chez des polytransfusés ou des
femmes multipares qui ont élaboré, à la suite de transfusions ou de grossesses
hétérospécifiques antérieures, des anticorps irréguliers, qui sont responsables
de la destruction des hématies transfusées. Les anticorps responsables de ces
accidents sont, le plus souvent, des anticorps anti-D, mais il peut aussi
s'agir d'anticorps d'une autre spécificité (anti-Kell, anti-C ou -c, anti-E ou
-e, anti-Duffy, etc...). La prévention de ces accidents repose sur la recherche
systématique de ces anticorps (agglutinines irrégulières) avant toute
transfusion, chez les polytransfusés et les femmes multipares.
Des
anémies hémolytiques dues à des auto-anticorps anti-érythrocytaires sont
parfois observées au cours ou au décours de certaines maladies virales, et au cours
de certaines maladies auto-immunes comme le lupus érythémateux disséminé. La
production de ces auto-anticorps anti-érythrocytaires résulte probablement de
l'importante perturbation des mécanismes immunorégulateurs, induite par les
infections virales ou associée aux maladies auto-immunes.
2)
Neutropénies
La plupart des granulopénies n'ont pas une origine
immunologique. Cependant, des auto-anticorps induisant la destruction des polynucléaires
neutrophiles ont pu être détectés chez des patients atteints de neutropénies
primitives (idiopathiques), ainsi que chez des patients atteints de
certaines maladies auto-immunes (lupus érythémateux disséminé, arthrite
rhumatoide, etc...).
1)
Thrombopénies
Certaines thrombopénies non induites par des médicaments
peuvent être attribuées à une HS du type II. Il s'agit du purpura
thrombopénique idiopathique et des thrombopénies associées à certaines maladies
auto-immunes comme le lupus érythémateux disséminé, malignes (leucémie
lymphoide chronique, lymphomes) ou infectieuses (mononucléose infectieuse,
maladies virales diverses). Ces diverses thrombopénies sont dues à des
auto-anticorps anti-plaquettaires.
B
– Manifestations diverses (de type auto-immunes)
Le syndrome de Goodpasture, qui associe une
atteinte rénale à une atteinte pulmonaire, est le seul type de
glomérulonéphrite qui soit dû à des auto-anticorps spécifiques d'organe; en
effet, les autres types de glomérulonéphrites sont, pour la plupart, dus à la
formation de dépôts de complexes immuns le long de la membrane basale
glomérulaire. L'atteinte pulmonaire associée au syndrome de Goodpasture résulte
d'une réactivité croisée des anticorps anti-membrane basale glomérulaire avec
la membrane basale pulmonaire.
Le
pemphigus et la pemphigoide bulleuse sont des maladies cutanées caractérisées
par des lésions bulleuses de grande taille. Il s'agit de maladies auto-immunes
qui sont dues à des auto-anticorps spécifiques de certains antigènes de la membrane
basale dermo-épidermique (pemphigoide bulleuse) ou de la substance
intersticielle de la peau (pemphigus).
Le
syndrome de Dressler est une atteinte cardiaque qui fait suite à un infarctus
du myocarde, et qui est dû à des auto-anticorps anti-coeur. La production de
ces anticorps résulte de la stimulation du système immunitaire par des
antigènes cardiaques plus ou moins modifiés, dont la libération massive dans
l'organisme s'effectue lors de l'accident coronarien.
Des anticorps cytotoxiques spécifiques d'organe ont été également mis en évidence chez certains patients atteints de stérilités d'apparence primitive (auto-anticorps anti-spermatozoides, anti-placentaires ou anti-ovariens), de sclérose en plaques (auto-anticorps anti-protéine basique majeure de la myéline), de diabète insulinodépendant (auto-anticorps anti-cellules b pancréatiques), voire de rhumatisme articulaire aigu (auto-anticorps anti-coeur) (cf. Chapitres sur les maladies autoimmunes).
HYPERSENSIBILITE PAR COMPLEXES
IMMUNS (HS DU TYPE III)
I – Introduction et généralités
A)
Définition et rôle physiologique
Les
complexes immuns (ou immuns complexes : IC) sont constitués de la combinaison
d'une ou de plusieurs molécule(s) d'antigène avec une ou plusieurs molécule(s) d'anticorps
spécifiques.
La formation d'IC dans l'organisme
est un phénomène normal, qui contribue à la neutralisation et à la destruction
physiologique des antigènes exogènes et des auto-antigènes dénaturés ou
altérés, en facilitant leur phagocytose.
B)
Circonstances de la pathogénicité des
immuns complexes
La
présence d'IC ne préjuge donc pas de leur pathogénicité. C'est leur persistance
dans la circulation ou/et les tissus qui risque de provoquer une réaction
inflammatoire anormale. La pathologie qui en résulte, et qui constitue
l'ensemble des phénomènes d'hypersensibilité du type III, correspond à des
situations associant, à une réponse anticorps variable, une stimulation
antigénique intense ou prolongée.
L'antigène
responsable peut provenir :
- soit
de l'environnement
- soit
d'une infection prolongée ou chronique ;
- soit
de l'individu lui-même, d'où des relations étroites avec la pathologie
auto-immunitaire.
C)Formation des IC
Les
complexes immuns peuvent se former :
- soit
avec un antigène introduit dans l'organisme ;
- soit
avec un antigène tissulaire ;
- soit
dans la circulation, où leur taille conditionne leur déplacement éventuel ;
- soit
à la surface d'une cellule.
Leur structure
dépend des forces d'union entre antigène et anticorps, mais aussi de liaisons
entre les fragments Fc d'un même isotype.
D)
Elimination des IC
Les IC
sont normalement éliminés plus ou moins rapidement par les cellules
mononucléées du foie, de la rate et des poumons. Leur taille conditionne pour
une grande part cette élimination : les IC dont le poids moléculaire (PM) est
supérieur à 1x106 D sont éliminés en quelques minutes par le foie. Les IC de
petite taille peuvent circuler pendant de longues périodes et échapper à la
phagocytose; mais ils risquent de se déposer, et de déclencher ainsi localement
une réaction inflammatoire.
La taille des
IC est donc un des facteurs essentiels de leur pathogénicité.
II – Facteurs de pathogénicité des immuns complexes
A)
Rôle de la taille des IC (Fig. 1)
1 – Rapport
antigène/anticorps
Le
rapport dans lequel antigène et anticorps se trouvent en présence
conditionne en grande partie la taille des IC : les immuns complexes de grande
taille, formés en zone d'équivalence ou en zone d'excès d'anticorps avec des
antigènes multivalents, sont généralement peu pathogènes, car aisément détruits
par les cellules phagocytaires. Cependant, ils peuvent parfois former des
dépôts intra-vasculaires, le long de la membrane basale (glomérulaire par exemple)
ou dans certains tissus, et être à l'origine de manifestations pathologiques
(phénomène d'Arthus, glomérulo-néphrites).
Les immuns
complexes de taille moyenne ou de petite taille, et notamment ceux de petite
taille qui se forment en zone d'excès d'antigène, sont les plus pathogènes. En
effet, ils circulent facilement (IC solubles), peuvent traverser les membranes
basales, et former des dépôts extravasculaires au niveau des tissus (versant
épithélial des glomérules rénaux par exemple). En outre, la localisation
tissulaire de ces IC rend plus difficile leur destruction par les cellules
phagocytaires. Enfin, les enzymes lysosomiales libérées par ces dernières ne
peuvent pas être inactivées comme elles le seraient, dans le sang ou le liquide
intersticiel, par des inhibiteurs sériques physiologiques.
2 – Affinité
de l’anticorps pour l’antigène
L'affinité de
l'anticorps pour l'antigène conditionne également la taille des IC. Plus elle
est forte, plus l'IC risque d'être de grande taille. Enfin, des facteurs surajoutés peuvent aussi contribuer à
augmenter la taille des IC : antiglobulines anti-isotypes ou anti-idiotypiques
; facteurs du complément (C1q, C3b, C4b) ; facteurs anti-complémentaires
(immunoconglutinines anti-C3 ou C4, facteurs H et C4BP).
B)
Rôle des facteurs hémodynamiques
La formation de dépôts d'IC au
niveau des tissus est favorisée par certains facteurs hémodynamiques :
1) régions de turbulences
circulatoires : courbures et bifurcations des vaisseaux sanguins (capillaires
rénaux et cutanés), valvules cardiaques, etc... ;
2) régions de pression
sanguine élevée (rein) ;
3) régions de filtration
(rein, plexus choroides, synoviale articulaire).
C)Rôle de l’activation du complément
Les dépôts d'IC activent le complément, soit par la voie
directe (IC à IgM et à IgG), soit par la voie alterne (IC à IgA notamment) ;
cette activation est un phénomène favorable, dans la mesure où la fixation des
facteurs du complément (C1q, C3b et C4b) limite la croissance infinie des
dépôts d'IC et favorise leur solubilisation. Mais elle a aussi pour
conséquences d'induire :
1)
une lyse des cellules du microenvironnement (activation jusqu'aux facteurs C8
et C9) ;
2)
la production de facteurs biologiquement actifs (C kinines, anaphylatoxines, C3b,
etc...), qui exercent d'importants effets pro-inflammatoires (cf. Fig. 2).
D)
Rôle de l’affinité tissulaire
Elle conditionne surtout la localisation des dépôts d'IC.
Affinité de certains antigènes : certains antigènes constitutifs des
complexes immuns ont une affinité particulière pour certains tissus. Ainsi,
l'ADN, qui entre dans la composition de la plupart des IC détectés chez les
patients atteints de LED (lupus érythémateux disséminé), possède une forte
affinité pour le collagène de la membrane basale glomérulaire, ce qui explique,
entre autres, la fréquence élevée des atteintes rénales dans le LED.
Affinité de certains anticorps : certaines classes et sous-classes
d'immunoglobulines se fixent plus aisément que d'autres au niveau des tissus ;
ainsi, par exemple, les IC à IgG2a sont beaucoup plus pathogènes que les IC à
IgM chez les souris NZB/NZW (BW). Ce phénomène s'explique probablement par le
fait qu'il existe de nombreux récepteurs pour le Fc des IgG2a dans les tissus
de ces souris.
E) Cryosolubilité
Cette propriété qu'ont certaines
immunoglobulines et certains complexes immuns de précipiter au froid ( < 20°
C), représente également un facteur responsable de la formation de dépôts d'IC
au niveau de certains tissus comme la peau (syndrome de Raynaud).
III – Pathologies liées aux immuns complexes
A
– Le phénomène d’Arthus
Ce phénomène, décrit en 1903 chez le lapin (réaction
inflammatoire locale liée à des injections répétées, par voie sous-cutanée, et
toujours au même endroit, de protéines hétérologues) fut alors considéré à tort
comme une forme particulière d'anaphylaxie locale, dans la mesure où, après la
phase de sensibilisation initiale par voie locale, la réintroduction de
l'antigène par voie veineuse induisait un choc mortel d'aspect anaphylactique.
Ce n'est qu'ultérieurement que le phénomène d'Arthus fut attribué à une
réaction d'HS du type III, sur la base des données fournies par les études
histologiques et immunologiques.
1 – Etude
expérimentale
Le phénomène d'Arthus est une réaction inflammatoire
locale qui peut être induite par l'administration répétée (à raison d'une
injection chaque semaine environ) d'une même substance à un même endroit de
l'organisme. Il s'agit bien d'un phénomène immunologique, puisque :
- la
substance injectée doit avoir les caractéristiques d'un antigène ;
-
la
réaction est spécifique, son déclenchement ne pouvant être obtenu que
par la réinjection de l'antigène sensibilisant ;
- les
premières injections, qui n'induisent aucune réaction visible, correspondent à
la phase de sensibilisation, et induisent la production d'anticorps spécifiques
(IgM, puis IgG) de l'antigène immunisant. Ces anticorps peuvent être détectés
dans le serum par des méthodes de précipitation simples in vitro (Ouchterlony),
et peuvent transférer passivement la sensibilisation à un animal non immunisé ;
- enfin,
l'immunofluorescence directe permet de détecter, au niveau des lésions, des
dépôts granuleux d'IC et de complément.
Les
aspects morphologiques du phénomène d'Arthus peuvent aisément être étudiés
lorsque l'antigène est injecté itérativement au niveau de la peau, par voie
intradermique (ID) ou sous-cutanée (SC): après la 2ème ou 3ème injection, se
produit une réaction inflammatoire locale, tout d'abord transitoire et
régressant après chaque injection, puis durable et caractérisée par de petites
lésions hémorragiques.
Enfin,
vers la 7ème ou 8ème injection, on observe une nécrose, parfois longue à
cicatriser.
L'étude chronologique,
anatomo-pathologique et histologique, permet de montrer que les lésions
évoluent en plusieurs étapes :
- une
phase initiale (premières heures suivant la réintroduction de l'antigène),
caractérisée par la formation intravasculaire d'agrégats plaquettaires,
associée à la formation de thromboses ;
-
une
phase ultérieure, pendant laquelle se constitue un infiltrat cellulaire riche
en polynucléaires neutrophiles (PMNs), auxquels s'associent des cellules
mononucléées, après la 24ème/48ème heure. Pendant cette phase, on observe
également, le plus souvent, une prolongation des modifications vasculaires
(agrégation plaquettaire, thromboses).
2 – Mécanisme
des lésions (fig 3 et 4)
Lorsque l'antigène est injecté par voie locale, une faible
quantité de cet antigène diffuse dans les vaisseaux sanguins avoisinants, où il
se combine avec les anticorps spécifiques apparus à la suite des stimulations
antigéniques précédentes. Il se forme alors localement des complexes immuns de
grande taille (en excès d'anticorps) qui, lors des premières injections,
restent dans la lumière vasculaire où ils sont aisément phagocytés; ceci
explique le caractère initialement peu intense et transitoire de la réaction
inflammatoire.
Lors
des injections ultérieures, des immuns complexes de plus grande taille se bloquent
dans les capillaires ; ces IC constitués d'IgM ou/et d'IgG vont activer le
complément par la voie directe. La formation de C3b qui en résulte induit une
agrégation et une activation des plaquettes, qui provoquent des thromboses
localisées, et libèrent leur contenu en amines vasoactives (histamine chez le
lapin).
D'autres
facteurs (C4a, C2b) exercent des effets vasodilatateurs ou vasoperméabilisants
directs.
D'autres
enfin (C3a, C5a) induisent une dégranulation non spécifique des polynucléaires
basophiles et des mastocytes; il s'ensuit une libération d'amines vaso-actives
et de PAF-acether, ce dernier concourant à entretenir l'agrégation et
l'activation plaquettaires. Le rôle joué par les mastocytes dans la pathogénie
de ces réactions d'HS semi-retardée est étayé par les résultats d'études
récentes menées chez les souris W/Wv (congénitalement dépourvues de
mastocytes), chez lesquelles la formation des dépôts tissulaires de complexes
immuns est significativement plus faible que chez les souris congéniques +/+
(possédant un nombre normal de mastocytes); de plus, une activation, par
l'antigène, de basophiles préalablement sensibilisés par des IgE spécifiques
formées, comme les IgM et les IgG, lors des premières injections de l'antigène,
entraîne exactement les mêmes conséquences.
La
conséquence immédiate de ces activations plus ou moins intriquées est une
hyperperméabilité des capillaires où sont bloqués les complexes immuns. Ceux-ci
peuvent alors facilement traverser la paroi de ces capillaires, et se déposer
dans les tissus adjacents.
Dans
une seconde étape, qui résulte de l'activation continue du système du
complément par les dépôts d'immuns complexes, se produisent les phénomènes
suivants :
- la
persistance des phénomènes vasculaires précédents (thromboses et augmentation
de la perméabilité capillaire) ;
-
l'attraction
et l'activation, par le C3a et le C5a, des polynucléaires neutrophiles, qui
libèrent leur contenu en enzymes lysosomiales toxiques dans
le microenvironnement; ces polynucléaires neutrophiles libèrent également
d'autres médiateurs (kallikréinogènes, PAF, leucotriènes, etc...), qui
contribuent à entretenir la réaction inflammatoire locale. Ils parviendront
toutefois, mais seulement au bout de plusieurs jours, à phagocyter les IC, d'où
l'évolution favorable, mais parfois prolongée, du phénomène d'Arthus. Il est
parfois possible d'observer, au sein de cet infiltrat cellulaire, un certain
nombre de polynucléaires éosinophiles; attirées sur place par le C5a et par
l'ECFA produit par les polynucléaires basophiles, ces cellules sont capables de
phagocyter les complexes immuns, mais libèrent dans le microenvironnement des
protéines basiques cytotoxiques. Quelques rares cellules monomacrophagiques
peuvent parfois être aussi observées; elles participent au processus
inflammatoire en libérant localement des médiateurs divers comme les
leucotriènes, le PAF, des collagénases, etc...
3 – Le
phénomène d’Arthus en pathologie humaine
Des réactions pathologiques dues à la
formation locale de dépôts de complexes immuns peuvent être observées dans
diverses circonstances, dans l'espèce humaine :
- injections
répétées de substances antigéniques à un même endroit de l'organisme (ACTH,
insuline de porc, sérums xénogéniques) ;
- rappels
de vaccinations (antidiphtérique, antitétanique, antipoliomyélitique) chez des
sujets hyperimmunisés ;
- enfin,
et surtout, alvéolites "allergiques" extrinsèques : ces affections,
anciennement appelées pneumopathies à précipitines, surviennent chez des sujets
exposés de façon prolongée et/ou répétée à l'inhalation de certains antigènes
organiques présents dans l'air ambiant. Il peut s'agir de moisissures du foin
(maladie des poumons de fermier), d'antigènes (plumes, IgA secrétoires des
défécations) d'origine aviaire (maladie des éleveurs d'oiseaux), et
d'allergènes divers (champignonistes, fabricants de certains fromages, etc...).
Sur le plan clinique et paraclinique, ces alvéolites se manifestent d'une façon
à peu près stéréotypée : elles débutent par des épisodes aigus (pneumopathie aiguë
fébrile, dyspnéisante et tussigène) qui surviennent 5 à 10 heures après
l'exposition à l'allergène. Suit une phase subaiguë, caractérisée par une
dyspnée qui tend à devenir permanente, spontanée et à l'effort, et qui
s'accompagne de toux, parfois de douleurs thoraciques, et d'un état
sub-fébrile, d'un amaigrissement et d'une altération de l'état général, tous
signes susceptibles de faire évoquer une tuberculose ou un cancer
broncho-pulmonaire. Il se développe ensuite une phase chronique, caractérisée par
une insuffisance respiratoire chronique (fibrose) qui se complique, à terme,
d'une insuffisance cardiaque chronique (coeur pulmonaire chronique). Au plan
radiologique, on observe des anomalies variables, qui s'aggravent
progressivement (syndrome intersticiel suivi de fibrose). Peuvent également
être observés une atteinte pleurale (pleurésie, pneumothorax ou/et
pneumomédiastin), des atélectasies, des infiltrats non systématisés et labiles
(très évocateurs d'une étiologie aspergillaire). Les explorations fonctionnelles
respiratoires (EFR) révèlent l'existence d'un syndrome restrictif associé à une
perturbation des échanges gazeux alvéolocapillaires; ces anomalies sont tout
d'abord transitoires (pendant et au décours des crises), puis deviennent
permanentes et de plus en plus marquées. L'étude immunohistologique des lésions
(lorsqu'elle est effectuée) révèle des aspects tout à fait analogues à ceux
décrits pour le phénomène d'Arthus: dépôts d'IC activant le complément;
richesse de l'infiltrat en polynucléaires neutrophiles; nécrose, puis évolution
fibreuse. Le diagnostic repose essentiellement sur la mise en évidence de
précipitines (anticorps précipitants) spécifiques de l'allergène incriminé dans
le serum et dans le liquide de lavage broncho-alvéolaire. Enfin, en l'absence
de traitement (qui doit être le plus précoce possible), elles évolueront vers
une fibrose intersticielle progressive, et mortelle à plus ou moins long terme.
Il
est certain que ces affections relèvent principalement d'une hypersensibilité
de type III. Néanmoins, certains arguments permettent fortement de penser que
participent aussi à leur pathogénie : des mécanismes dépendants des IgE
(fréquente association à des réactions allergiques du type immédiat,
respiratoires (asthme) ou non (urticaire) ; fréquente augmentation du taux des
IgE sériques totales et spécifiques ; augmentation du nombre des mastocytes et
de la concentration en histamine dans le liquide de lavage broncho-alvéolaire;
augmentation du nombre des macrophages alvéolaires FceR-II+, probablement
sensibilisés par des IgE) ; une réaction d'hypersensibilité retardée, rendant
compte de certaines réactions granulomateuses ; enfin, une activation de
l'immunité non spécifique (système du complément, macrophages alvéolaires) par
les antigènes incriminés.
B – La maladie sérique aiguë
1 – La maladie
sérique aiguë chez l’homme
Cette affection survient généralement lors de la première
administration d'un antigène dans l'organisme. Il s'agit le plus souvent de
serums hétérologues (serums antitétanique, antidiphtérique ou antivenimeux
d'origine animale), mais il peut aussi s'agir d'autres antigènes comme certains
médicaments (béta-lactamines et sulfamides notamment).
Les
symptômes de la maladie sérique aiguë apparaissent en général entre le 5ème et
le 10ème jour qui suivent l'administration de l'antigène, et régressent
spontanément après le 10ème/15ème jour. Dans les formes complètes, on observe:
-
de
la fièvre (généralement modérée);
-
une
protéinurie;
- une
éruption cutanée (scarlatiniforme, morbilliforme ou urticarienne);
- des
arthralgies (fréquentes et atteignant généralement plusieurs articulations);
- des
adénopathies;
-
parfois,
des manifestations neurologiques (polynévrite) ou cardiovasculaires (thrombose
coronarienne).
2 – La maladie
sérique aiguë expérimentale
Pendant longtemps aucune interprétation satisfaisante ne
put être donnée à la maladie sérique humaine, du fait de ses caractéristiques
(survenue lors de la première administration de l'antigène, chronologie particulière),
ne permettant de l'assimiler à aucune des manifestations d'hypersensibilité
connues, humorales ou cellulaires. La compréhension des mécanismes
immunologiques impliqués ne fut permise que tardivement, grâce aux études
expérimentales menées chez l'animal (lapin) et pratiquées avec des antigènes
radiomarqués dont on peut suivre le devenir dans l'organisme.
a
- Réalisation expérimentale : lors d'une première injection
de sérum-albumine bovine (BSA) à forte dose (5 à 10 g) par voie intraveineuse,
on observe l'apparition, entre les 9ème/10ème jours et les 15ème/20ème jours,
de troubles très proches de ceux observés au cours de la maladie humaine:
- glomérulonéphrite
aiguë avec protéinurie abondante ;
- légère
augmentation de la pression artérielle ;
- atteinte
myocardique, s'accompagnant parfois d'une insuffisance ventriculaire gauche ;
- manifestations
vasculaires périphériques (artérite) inconstantes ;
- éruptions
cutanées érythémateuses, particulièrement bien visibles chez les lapins blancs.
L'étude
de la courbe de disparition de la BSA radiomarquée (Iode 131) et de la courbe
d'apparition des anticorps anti-BSA révèle les phénomènes suivants (cf. Fig. 5)
:
- dans
un premier temps, une diminution rapide de la concentration plasmatique de l'antigène,
due à sa répartition dans le secteur vasculaire ;
- dans
un second temps (entre le 2ème et le 7ème jour), on assiste à une diminution
normale de la concentration plasmatique de l'antigène ;
- enfin,
pendant la 2ème semaine, c'est-à-dire pendant la période où se manifestent les
troubles cliniques, on observe une cassure de la courbe qui correspond à une
accélération de la vitesse de disparition de l'antigène, qui finit par ne plus
être décelable dans le sérum. C'est alors, vers la fin de la 2ème semaine, que
l'on peut mettre en évidence une brusque apparition des anticorps circulants
spécifiques, dont le taux croît rapidement pour atteindre un plateau maximal
vers le milieu de la 3ème semaine.
On
ne peut ainsi jamais observer la présence simultanée, dans le sérum, de
molécules libres d'antigène ni d'anticorps. En revanche, on peut détecter dans
le sérum, mais surtout au niveau des tissus, des complexes immuns constitués de
l'antigène administré et d'anticorps spécifiques. La période de détection de ces
IC correspond à la période des troubles cliniques (du 9ème/10ème jour au
17ème/20ème jour).
On
peut également mettre en évidence, pendant cette période, une baisse du taux du
complément sérique, due à l'activation du complément par les dépôts d'IC; la
présence d'IC activant le complément a bien été mise en évidence par
immunofluorescence, au niveau des lésions caractérisant la maladie sérique
aiguë. Ultérieurement, le taux du complément sérique se normalise
progressivement après le 18ème/20ème jour.
b
- Mécanismes immunologiques : après son injection, l'antigène
peut être détecté sous forme libre, dans le serum, pendant 5 à 7 jours environ,
période pendant laquelle s'effectue la sensibilisation.
Dès
qu'ils apparaîssent, les anticorps spécifiques, élaborés en réponse à la
stimulation antigénique, se combinent avec l'antigène, et forment des IC
circulants de petite taille (en excès d'antigène); ces IC se déposent au niveau
des tissus, où ils induisent des lésions par un mécanisme analogue à celui
décrit pour le phénomène d'Arthus. C'est pendant cette période que se
manifestent les symptômes de la maladie.
Après
le 12ème/15ème jour, toutes les molécules d'antigène se sont combinées sous
forme de complexes immuns, et l'on observe alors une augmentation du taux des
anticorps spécifiques libres dans le serum.
Enfin,
après le 15ème/20ème jour, tous les dépôts d'immuns complexes ont été détruits,
et les symptômes régressent progressivement.
3 – Diagnostic
Le
diagnostic d'une maladie sérique aiguë ou de ses équivalents repose donc sur :
- la
symptômatologie évocatrice (nature des symptômes, guérison spontanée) ;
- l'interrogatoire,
à la recherche d'une injection de serum hétérologue ou d'une prise de
médicaments quelques jours avant l'apparition des troubles ;
- le
dosage du complément hémolytique, dont le taux est significativement abaissé
(consommation du complément au niveau des dépôts d'IC).
Exceptionnellement,
on pourra avoir recours à l'immunofluorescence directe (mise en évidence de
dépôts granuleux d'IC et de complément, au niveau des lésions), à la recherche
et au dosage, dans le serum, des IC circulants (voir plus loin), et à la
recherche et au titrage, après le 15ème/20ème jour, d'anticorps précipitants
spécifiques de l'antigène incriminé, dans le serum.
C – La maladie sérique chronique
Elle résulte de la formation continue de complexes immuns
circulants, lorsque l'antigène est administré itérativement pendant plusieurs
semaines ou plusieurs mois, chez l'animal, en adaptant la dose à la réponse anticorps,
de façon à maintenir une situation en "excès d'antigène". Les
complexes immuns se localisent essentiellement au niveau du rein, où ils
induisent une glomérulonéphrite durable, associée à un syndrome néphrotique
(protéinurie, hypoprotidémie, hyperlipémie).
D – Autres maladies dues à des IC
circulants
Chez l'animal : l'exemple-type des maladies dues à des complexes
immuns circulants chez l'animal est la maladie auto-immune des souris NZB et BW
(NZBxNZW), qui associe une anémie hémolytique auto-immune (par auto-anticorps
anti-érythrocytaires) et une glomérulonéphrite due à des dépôts d'immuns
complexes constitués d'auto-anticorps antinucléaires et de DNA.
Dans l'espèce humaine : de nombreuses maladies humaines résultent, au moins en
partie, de la formation d'IC circulants se déposant au niveau des tissus :
- les
maladies auto-immunes diffuses (non organospécifiques), et notamment le LED et
l'arthrite rhumatoide ;
- certaines
maladies infectieuses, virales (éruptions cutanées de la varicelle, de la
rougeole, de la rubéole ; arthralgies et urticaire de l'hépatite B) ou
bactériennes (glomérulonéphrites d'origine streptococcique, voire
staphylococcique), voire mycobactériennes (lèpre) ou parasitaire. Dans tous ces
cas, la pathologie liée aux complexes immuns n'est qu'un épiphénomène de la
maladie causale.
Dans
de nombreux cas, on observe la formation d'IC, à laquelle il est impossible de
rapporter une pathologie quelconque. D'autre part, des IC circulants peuvent
être détectés chez des sujets parfaitement sains, et notamment chez les sujets
âgés. Ces observations doivent donc susciter une grande prudence dans
l'interprétation des méthodes de détection des immuns complexes et la
signification des complexes immuns ainsi détectés.
Le
rôle des IC au cours de certaines maladies reste donc encore bien souvent
incertain: ainsi, par exemple, on observe fréquemment des taux élevés d'IC
circulants chez la plupart des patients cancéreux, ainsi qu'au cours de certaines
leucémies. Il s'agit d'IC constitués d'antigènes tumoraux et d'anticorps
spécifiques. Si ces immuns complexes sont bien, dans certains cas, le reflet de
la réponse immunitaire de rejet des tumeurs, dans d'autres cas, ils paraissent
plutôt être responsables d'une immunodépression préjudiciable.
IV – Méthodes de détection des immuns
complexes
A) Détection des IC circulants
Méthodes physiques : certaines d'entre elles sont basées sur le fait que les
CIC ont un PM élevé (ultracentrifugation, précipitation sélective des IC par le
polyéthylène-glycol ou PEG) ; les autres sont basées sur la propriété qu'ont
certains immuns complexes de précipiter à basse température (< 20° C), alors
qu'ils restent solubles à des températures plus élevées (cryo-précipitation).
Quelle
que soit la méthode utilisée, il est possible de redissoudre le précipité ou le
culot de centrifugation qui contient les complexes immuns, et d'y doser les
immunoglobulines par la méthode de Mancini ou par radioimmunologie.
Méthodes biologiques : elles sont nombreuses. Les principales
sont :
- la
méthode de fixation sur du C1q, ou les IC se fixent sur du C1q, lui-même fixé
sur un support, cette fixation pouvant être révélée par des antiglobulines
radiomarquées ou combinées à une enzyme ;
- la
méthode des cellules Raji : les cellules Raji sont des cellules
lymphoblastoides qui possèdent des récepteurs pour le Fc des immunoglobulines
et pour les facteurs C1q et C3 du complément. Les IC se fixent donc sur les
cellules Raji par leurs fragments Fc, ainsi que par les facteurs d'origine
complémentaire qu'ils ont fixés et activés in vivo. Ainsi fixés sur les
cellules Raji, les complexes immuns circulants peuvent être révélés par des
antiglobulines radiomarquées.
Citons
également:
- la
méthode de l'agrégation plaquettaire: ce test est basé sur la propriété qu'ont
les complexes immuns de se fixer sur les récepteurs pour le Fc des
immunoglobulines présents sur la membrane des plaquettes;
- l'inhibition
de la fixation d'anticorps radiomarqués sur les facteurs rhumatoides: les
facteurs rhumatoides sont, pour l'essentiel, des IgM anti-IgG ayant une forte
affinité pour les IgG. En se fixant sur ces facteurs rhumatoides, les IC à IgG
inhibent la fixation d'IgG agrégées radiomarquées.
Valeur de ces méthodes : d'une façon générale, les diverses méthodes de
détection et de dosage des complexes immuns circulants ont une faible valeur
diagnostique, notamment parce qu'elles permettent également de détecter les
agrégats d'immunoglobulines, et peuvent ainsi donner des résultats faussement
positifs. D'ailleurs, le grand nombre de méthodes non spécifiques de détection
des IC circulants est bien le reflet de leur faible valeur diagnostique.
Seule
la méthode de fixation sur du C1q échappe (en partie) à cette critique, du fait
que le C1q se combine avec beaucoup plus d'affinité aux complexes immuns qu'aux
agrégats d'immunoglobulines.
B)
Détection des dépôts d'IC
la détection des dépôts d'IC repose essentiellement sur
l'immunofluorescence. La mise en évidence de dépôts d'immunoglobulines dans les
tissus apporte des arguments en faveur de la présence de complexes immuns,
surtout quand ces dépôts ont un aspect granuleux et quand ils sont associés à
la présence de complément.
Cependant,
l'immunofluorescence peut également mettre en évidence la présence
d'auto-anticorps dirigés contre certains antigènes tissulaires. Enfin, elle
peut parfois détecter des dépôts non spécifiques d'immunoglobulines.
C)
Méthodes spécifiques de détection des IC
il s'agit de méthodes d'identification d'IC dont
l'antigène est connu ou suspecté, ou peut être aisément mis en évidence. Ces
méthodes basées sur des techniques radio-immunologiques ou sur la microscopie
électronique sont les seules qui aient une valeur diagnostique réelle;
cependant, elles se heurtent à un certain nombre de difficultés, d'ordre
technique notamment.
IMMUNITE A MEDIATION CELLULAIRE
ET HYPERSENSIBILITE RETARDEE (HS DU TYPE IV)
I - Introduction
On
peut parler indifféremment d'immunité à médiation cellulaire (IMC) ou
d'hypersensibilité retardée (HSR), dans la mesure où l'HSR n'est que la
manifestation pathologique des réponses immunitaires à médiation cellulaire,
les mécanismes impliqués au cours des réponses IMC et des réactions d'HSR étant
tout à fait identiques. En outre, la confusion entre les deux termes est
accentuée par le fait que l'on parle couramment "d'allergie
tuberculinique" pour exprimer l'existence d'une sensibilisation de type
cellulaire tout à fait profitable à l'organisme, puisque susceptible de le
protéger contre le risque d'infection par le bacille tuberculeux (voir plus
loin).
Les réactions
immunitaires à médiation cellulaire jouent un rôle physiologique important dans
la défense de l'organisme contre les infections par les microorganismes à
développement intracellulaire (mycobactéries et virus notamment), et dans la
résistance aux tumeurs. Les réactions d'HSR sont le principal type de réactions
impliquées dans le rejet des allogreffes ; enfin, comme celà sera revu
ultérieurement, les réactions d'HSR peuvent être à l'origine de certaines
affections pathologiques comme les eczémas de contact, les allergies
microbiennes et parasitaires, l'érythème noueux, voire certaines maladies auto-immunes.
Trois grands
types de réactions d'HSR ont été décrits : les réactions d'HSR
"classiques" (de type tuberculinique), qui constituent le principal
modèle d'étude des réactions d'HSR, et qui ont permis d'en déterminer les
principaux critères ; les réactions d'HSR (cutanée) à basophiles, ou réactions
de Jones-Mote, qui caractérisent notamment la phase de début des dermites de
contact et les urticaires chroniques, et dont les mécanismes n'ont été élucidés
que récemment ; les réactions d'HSR cytotoxique enfin, essentiellement
impliquées dans les réactions de rejet d'allogreffe et de défense anti-virale
et anti-tumorale.
II – La réaction d’HSR classique (de type tuberculinique)
A) Aspects historiques: "l'allergie de la tuberculose"
1 – Le
phénomène de Koch (1891)
Si,
chez un cobaye ayant reçu une première injection de bacilles tuberculeux (BK)
vivants par voie sous-cutanée (SC), on pratique, après un délai de quelques
semaines, une seconde injection de BK par voie intradermique (ID), on observe,
24 à 48 heures après cette seconde injection, une réaction inflammatoire locale
dont les aspects chronologiques et morphologiques (induration) contrastent avec
ceux des autres réactions d'hypersensibilité.
La réaction
tardive ainsi induite évolue ultérieurement vers la nécrose, puis l'élimination
de l'escarre, sans adénopathie régionale, ni dissémination bacillaire. Les BK
réintroduits dans l'organisme sont en effet détruits et éliminés (immunité de
surinfection) ; par contre, le cobaye meurt quelques semaines plus tard de sa
primo-infection tuberculeuse.
2 – L’allergie
tuberculinique
Le même type de réaction peut être observé si l'on injecte
par voie ID, chez un cobaye préalablement sensibilisé par une injection de BK
vivants, des produits obtenus à partir de filtrats de BK en culture
(tuberculine). Si la tuberculine est injectée par voie intraveineuse (IV), on
observe une réaction générale caractérisée par une hyperthermie transitoire, à
la 24ème/48ème heure.
Les
tests cutanés à la tuberculine sont utilisés couramment chez l'homme pour
détecter une sensibilisation préalable, résultant parfois d'une infection
tuberculeuse, le plus souvent d'une vaccination par le BCG.
B)
Critères généraux de l'HSR
1 –
Thymodépendance des réactions d’HSR
Les études in vivo ont permis de démontrer que les
réponses immunitaires à médiation cellulaire et les réactions
d'hypersensibilité retardée étaient très dépendantes du thymus et des
lymphocytes T, et que les anticorps y jouaient un rôle négligeable. Ainsi :
- aucune
anomalie de l'IMC ne peut être détectée chez les patients atteints de déficits
purs de l'immunité humorale (a/hypogammaglobulinémies
congénitales/héréditaires), non plus que chez les animaux bursectomisés à la
naissance. En revanche, aucune sensibilisation de type cellulaire et aucune
réaction d'HSR ne peuvent être obtenues chez les animaux ou les individus
athymiques (souris nude ou thymectomisées à la naissance; syndrome de Di
George) ;
-
le
transfert passif des sensibilisations de type cellulaire ne peut être réalisé
que par des lymphocytes T provenant d'animaux préalablement sensibilisés de
façon adéquate, et non par leur serum (anticorps).
2 – Conditions
de la sensibilisation
a
- absence de prédisposition immunologique individuelle : sous réserve d'avoir
été convenablement immunisé, n'importe quel animal ou individu peut développer
une sensibilisation de type cellulaire, et présenter une réaction d'HSR lorsque
l'antigène est réintroduit dans l'organisme.
Ainsi,
contrairement à ce qui se produit dans l'allergie immédiate, où il existe un
terrain prédisposant (terrain atopique), l'HSR est un phénomène qui ne requiert
aucune prédisposition immunologique particulière. Si, au cours des dermites de
contact, l'HSR apparaît avec des délais variables et pour des expositions
variables à l'antigène, les différences entre individus n'ont aucun
support immunologique, et ne sont probablement dues qu'à des variations
interindividuelles de la réactivité cutanée (possibilités de couplage entre les
allergènes et les protéines cutanées; teneur de la peau en cellules de
Langerhans, voire en mastocytes : cf. plus loin).
b
- nature des antigènes et conditions d'administration :
expérimentalement, l'induction d'une sensibilisation de type cellulaire doit
répondre à certaines règles :
- seuls
les antigènes de PM élevé, ou dont le PM est augmenté par une combinaison
spontanée, dans l'organisme, avec des molécules porteuses de PM élevé, sont
susceptibles d'induire une sensibilisation de type cellulaire. Ainsi, certaines
substances chimiques simples de faible PM (haptènes), comme le chrome ou le
nickel présents dans la poudre de ciment et certains bijoux, sont capables
d'induire une sensibilisation de type cellulaire et des réactions d'HSR
(dermites des cimentiers, etc...), en se combinant avec les protéines et
glycoprotéines de la peau.
L'immunogénicité
croît avec le PM des substances sensibilisantes: au maximum, les
sensibilisations les plus fortes sont obtenues pour des antigènes exprimés sur
la membrane des cellules vivantes : ainsi, une sensibilisation modérée peut
être obtenue par l'administration de BK tués, alors que des BK vivants (ou du
BCG) induisent une très forte sensibilisation. Cette particularité explique le
rôle de l'IMC et des réactions d'HSR dans la défense de l'organisme contre les
infections par les microorganismes à développement intracellulaire, contre le
cancer, et dans les rejets d'allogreffe.
- les
doses utilisées doivent être relativement faibles (les doses relativement
fortes induisant préférenciellement une immunité humorale), tout du moins en ce
qui concerne les antigènes protéiques, et les sensibilisations les plus fortes
sont obtenues lorsque l'antigène est administré par voie intradermique ou
sous-cutanée.
- enfin,
les adjuvants renforcent considérablement les sensibilisations de type
cellulaire a ainsi, si la tuberculine injectée seule est incapable d'induire
une sensibilisation de type cellulaire, l'injection simultanée de cire ou
d'adjuvants divers (adjuvant de Freund notamment) permet d'induire une immunité
tuberculinique à peu près comparable à celle obtenue par l'injection de BK
vivants, chez l'animal d'expérience.
L'importance
des facteurs adjuvants a également été mise en évidence au cours de certaines
réactions pathologiques d'HSR, dans l'espèce humaine: ainsi, les rayons UV
renforcent l'immunogénicité de nombreuses substances exogènes, en augmentant la
combinaison de ces substances (haptènes) avec les protéines de l'organisme, et
en stimulant la production de certains facteurs amplificateurs de la réponse
immunitaire, comme l'IL-1 ou ETAF (dermites de contact). Les rayons UV sont par
ailleurs capables de dévoiler l'immunogénicité de certains constituants propres
à l'organisme (auto-antigènes), et d'induire ou de favoriser le développement
de certaines maladies auto-immunes.
3 – Aspects
des réactions d’HSR
- aspects
chronologiques : comme celà a déjà été évoqué, les réactions d'HSR se
distinguent des autres réactions d'hypersensibilité par leurs aspects
chronologiques. Lors de la réintroduction de l'antigène sensibilisant dans
l'organisme, la réaction inflammatoire qui caractérise les réactions d'HSR
débute à la 6ème/12ème heure seulement, et atteint son maximum à la 24ème/48ème
heure, pour se résorber ensuite progressivement en quelques jours.
Cependant,
cette réaction tardive est souvent précédée par une réaction inflammatoire plus
précoce (premières heures suivant la réintroduction de l'antigène), dont la
signification sera discutée ultérieurement.
- aspects
morphologiques : alors que
l'allergie immédiate est caractérisée par des lésions érythémateuses et
oedémateuses, les réactions d'HSR se traduisent par un érythème induré qui,
cependant, est parfois associé à une spongiose et à la formation de vésicules,
comme dans le cas des eczémas de contact. Cette induration résulte de
l'abondance en cellules dans l'infiltrat sous-jacent, et de l'épaississement de
l'épiderme, lorsque la réaction d'HSR se produit au niveau de la peau (cf.
ci-dessous).
- aspects
histologiques :
si, pendant les premières heures qui suivent la réintroduction de l'antigène
dans l'organisme, on observe un infiltrat polymorphe contenant à la fois des
cellules mononucléées et des polynucléaires neutrophiles (PMNs), voire des
basophiles, les réactions d'HSR classiques sont caractérisées, à partir de la
12ème/24ème heure, par un infiltrat abondant, constitué exclusivement de
cellules mononucléées.
Ces
cellules proviennent pour la plupart de la circulation sanguine, puis
prolifèrent sur place, dans un second temps, comme le démontrent les résultats
des études autoradiographiques. L'étude de leurs caractéristiques cytologiques
(microscopie optique et électronique), histochimiques et antigéniques
(antigènes de différenciation) a permis de montrer que l'infiltrat associé aux
réactions d'HSR comportait environ 50 p.cent de lymphocytes T (lymphocytes T
CD4+ essentiellement) et 50 p.cent de cellules de la lignée monomacrophagique
ou de cellules apparentées (cellules de Langerhans, au niveau de la peau). Des
lymphocytes B, en nombre variable, peuvent également être détectés au sein de
cet infiltrat.
Au
niveau de la peau, cette infiltration cellulaire, qui est tout d'abord purement
intradermique, gagne ensuite l'épiderme, où elle atteint son maximum entre la
24ème et la 72ème heures, avant de régresser très progressivement.
Ainsi,
les aspects histologiques des réactions d'HSR du type tuberculinique diffèrent
fondamentalement de ceux qui peuvent être observés dans les réactions
d'allergie immédiate, qui sont caractérisées par un oedème prédominant et par
un infiltrat pauvre en cellules, et où prédominent les éosinophiles. Ils
diffèrent également des aspects observés dans les réactions d'HS semi-retardée,
qui sont caractérisées par un infiltrat où prédominent les polynucléaires neutrophiles.
4 –
Difficultés de la désensibilisation spécifique
Comme cela sera revu plus loin,
certaines allergies (microbiennes notamment) relèvent d'une HSR. Ces états
pathologiques échappent généralement à la désensibilisation spécifique.
Celle-ci
a bien pu être réalisée expérimentalement chez l'animal (voir plus loin), mais,
en règle générale, elle est imparfaite et transitoire; de plus, elle se heurte
au risque d'exacerbation des manifestations allergiques, et donc à un risque
d'aggravation de l'état des patients.
C) Mécanismes immunologiques des
réactions d'HSR
1 – Phases de
sensibilisation
Dans les jours qui suivent la première immunisation par un
antigène, une certaine proportion des lymphocytes T prolifère (transformation
lymphoblastique) au niveau de la région paracorticale des ganglions
lymphatiques locorégionaux. Il s'agit de lymphocytes Th1 possédant des
récepteurs spécifiques pour l'antigène, qui vont ainsi donner naissance à un
plus grand nombre de lymphocytes T spécifiques (expansion clonale), et
notamment à des lymphocytes Th1 mémoire à vie longue, qui pourront rapidement
reconnaître l'antigène sensibilisant lorsqu'il sera introduit à nouveau dans
l'organisme.
L’activation
de ces lymphocytes fait suite à la migration des cellules présentatrices
d'antigène, du site de la stimulation antigénique vers les ganglions
lymphatiques loco-régionaux, où ces cellules présentent l'antigène aux
lymphocytes T.
L'orientation
de la réponse immunitaire, ainsi induite, vers une réponse du type Th1, résulte
de la production simultanée d'IL-12 par les cellules présentatrices d'antigène.
Le rôle déterminant de cette cytokine dans l'induction des sensibilisations de
type cellulaire est étayé par les résultats d'études récentes diverses montrant
que :
- chez
les souris sensibilisées par des allergènes divers, l'injection d'IL-12 induit
une réponse immunitaire à médiation cellulaire, alors que les anticorps
anti-IL-12 inhibent le développement des réponses IMC ;
- in
vitro, les cellules présentatrices d'antigène (cellules dendritiques)
présentent des interactions membranaires avec les LyTh1 (mais pas avec les
LyTh2), et produisent alors de l'IL-12.
3.2. Déclenchement des réactions
d'HSR : ce sont les études in vitro qui ont permis de comprendre les mécanismes
immunologiques impliqués dans les réactions d'HSR, et de démontrer que ces
réactions se déroulaient en deux phases distinctes, bien que partiellement
intriquées: une phase inductrice/amplificatrice spécifique initiale, puis une
phase effectrice non spécifique.
Pendant
la phase inductrice/amplificatrice initiale, qui peut être objectivée in vitro
par le test de transformation lymphoblastique (TTL : voir plus loin), les
lymphocytes Th1 mémoire spécifiques de l'antigène sensibilisant reconnaissent
l'antigène qui leur est présenté par les cellules auxiliaires de l'immunité, et
produisent de l'IL-2, qui contribue à recruter et à activer localement un plus
grand nombre de lymphocytes T ; ces derniers prolifèrent et donnent naissance à
de nouveaux lymphocytes T mémoire, d'une part, et à des lymphocytes T
effecteurs, d'autre part.
Pendant
la phase effectrice, les lymphocytes T effecteurs, ainsi recrutés et activés,
produisent des cytokines qui vont, à leur tour, recruter et activer des
leucocytes d'origine sanguine. Les premières lymphokines synthétisées sont le
LIF (facteur inhibant la migration des leucocytes) et le LAF (facteur
activateur des leucocytes, et notamment des PMNs), ce qui explique l'afflux
initial des polynucléaires neutrophiles, pendant les premières heures de la
réaction d'HSR.
Ultérieurement,
les lymphocytes T effecteurs produisent des cytokines chimiotactiques et
activatrices pour les cellules monomacrophagiques et les cellules apparentées,
comme les cellules de Langerhans. Il s'agit notamment du MCP
(macrophage-chemotactic protein-1), et du MIF/MAF (macrophage
migration-inhibiting factor/macrophage-activating factor) ; le rôle joué par
ces cytokines est étayé par les résultats des études expérimentales effectuées
chez l'animal, et ayant montré que les injections d'anticorps anti-MCP-1
inhibaient l'expression des réactions cutanées d'HSR.
La production de ces cytokines peut être objectivée in vitro par diverses méthodes, et notamment par le test d'inhibition de la migration leucocytaire ou TML (voir plus loin). Des études récentes ont permis de caractériser la nature biochimique (glycoprotéines) de ces cytokines, ainsi que certaines de leurs propriétés physiques (PM 22 500-55 000) et biologiques (activation des processus phagocytaires, bactéricides et tumoricides des macrophages, etc..). Les résultats de ces études permettent de penser que le MIF, le MAF et l'IFN-g ne sont qu'un seul et même facteur, ou des facteurs étroitement apparentés.
Ainsi
recrutées et activées localement, les diverses cellules de l'infiltrat, et
notamment les cellules monomacrophagiques, vont détruire l'antigène et induire
des lésions tissulaires, en libérant dans le microenvironnement certaines
substances cytotoxiques (enzymes lysosomiales, anions peroxyde, eau oxygénée,
etc...) et/ou en s'attaquant directement aux cellules sur lesquelles est fixé
l'antigène.
Enfin,
certaines cytokines contribuent à stimuler la prolifération des kératinocytes,
ce qui se traduit par un épaississement de l'épiderme, au niveau des réactions
d'HSR cutanées, ou à stimuler, d'une façon plus générale, la réaction
inflammatoire (IL-6).
D) Contrôle des réactions d'HSR
Les
mécanismes immunologiques qui contribuent à inhiber les réponses IMC et les
réactions d'HSR présentent certaines particularités qui permettent de les
distinguer de ceux qui contrôlent les réponses anticorps et les réactions d'HS
immédiate. Les cellules en cause sont :
d'une part, des
lymphocytes T "suppresseurs" classiques, spécifiques de la
fraction porteuse (carrier) de l'antigène, et non de ses déterminants
hapténiques ;
d'autre part, les
cellules monomacrophagiques, recrutées et activées sur le site de la
réaction d'HSR : l'hypothèse selon laquelle la suppression des réponses IMC est
essentiellement effectuée par ces cellules est étayée par le fait que, chez le
cobaye, les injections de fortes quantités de MIF induisent une suppression de
la réactivité immunologique de type retardé, en stimulant la production, par
les macrophages, de facteurs retrouvés dans le sérum, et qui dépriment la
production des cytokines par les lymphocytes T.
Il s'agit,
entre autres :
- de
prostaglandines (PGE2) et de dérivés lipo-oxygénés de l'acide arachidonique
(LTB4 et 15-HETE) ;
- de
la chaîne p40 de l'IL-12, qui se comporte comme un antagoniste compétitif de
l'IL-12, au niveau de ses récepteurs.
enfin, et surtout, les
lymphocytes Th2, recrutés et activés secondairement : le rôle de ces
cellules dans l'inhibition des réponses IMC et des réactions d'HSR est étayé
par les résultats des études expérimentales et humaines ayant montré :
- une
forte expression des cytokines du type Th2 (IL-4 et IL-10 notamment) sur le
site des réactions d'HSR, à partir des 24e/36e heures ;
- une
augmentation significative de l'expression des réactions cutanées d'HSR chez
les souris déficientes en IL-10 ;
-
les
effets inhibiteurs de l'IL-10 sur la production in vitro d'IL-12 par les
cellules présentatrices d'antigène, et les effets potentiateurs des anticorps
anti-IL-10 sur la production d'IL-12, et sur le développement des réponses IMC
et des réactions d'HSR in vivo.
E) Aspects particuliers des réactions
d'HSR
1 – Rôle des
polynucléaires neutrophiles
Les résultats de diverses études
expérimentales, effectuées chez l'animal, permettent de suggérer que ces
cellules pourraient moduler les réponses IMC et les réactions d'HSR, tantôt en
produisant des cytokines inductrices/amplificatrices (IL-1 notamment), tantôt
en produisant des médiateurs immunosuppresseurs et anti-inflammatoires (PGE2).
2 – Rôle des lymphocytes B
Un certain nombre de lymphocytes B peut être détecté au
sein de l'infiltrat qui caractérise les réactions d'HSR. Le rôle précis de ces
cellules n'est pas encore parfaitement clarifié ; néanmoins, il semble qu'elles
pourraient participer activement à la phase inductrice/amplificatrice initiale
des réactions d'HSR, en présentant l'antigène aux lymphocytes T, et/ou en
produisant certains facteurs amplificateurs non spécifiques comme l'IL-1.
D'autre
part, certaines études ont permis de montrer que les lymphocytes B pouvaient
jouer le rôle de cellules effectrices de l'HSR, en produisant des lymphokines
comme le MIF et le MAF, ainsi que de la lymphotoxine, cytotoxique pour les
cellules tumorales.
Enfin,
les résultats d'études diverses, dont certaines déjà anciennes, suggèrent fortement
que les anticorps produits par les lymphocytes B pourraient moduler
l'expression des réponses IMC et des réactions d'HSR (cf. infra).
3 – Effets modulateurs des anticorps sur les réaction d’HSR
Si, 15 jours à trois semaines après une sensibilisation de
type cellulaire, on réintroduit l'antigène sensibilisant dans des conditions
telles qu'il va stimuler essentiellement la production des anticorps (voie IV
ou intrapéritonéale ; dose plus forte, en l'absence d'adjuvant), on observe une
inhibition complète des possibilités de réponse immunitaire du type cellulaire.
Cette inhibition (phénomène de split-tolerance) est due à des anticorps dont
les effets suppresseurs sur l'IMC ont pu être confirmés par des expériences de
transfert passif. Il s'agit d'IgG dont la nature et la spécificité ont pu être
reconnues récemment:
-
certaines de ces IgG (IgG-2 notamment, chez la souris) sont spécifiques de
l'antigène (id+), et activeraient des cellules suppressives (lymphocytes T,
cellules monomacrophagiques), soit sous forme libre, soit sous forme de
complexes immuns ;
-
les autres sont des anticorps anti-idiotypiques, qui pourraient activer des
lymphocytes T suppresseurs spécifiques. La production de tels anticorps a été
récemment mise en évidence chez des souris infectées par le BCG.
Il
apparaît ainsi que les anticorps sont capables d'exercer des effets
suppresseurs sur les réponses IMC et les réactions d'HSR.
Cependant,
les immuns complexes (IC à IgM, à IgG-1 et à IgG-3, chez la souris), et des
anticorps anti-idiotypiques, dont la production a été récemment détectée au
cours de certaines réactions d'HSR, seraient également capables de renforcer la
réactivité immunologique du type retardé, en inactivant les lymphocytes T
suppresseurs impliqués dans le contrôle des réactions d'HSR, et en favorisant
le recrutement et l'activation des lymphocytes Th1 spécifiques par l'antigène.
III - L'HSR de type cytotoxique
Les
réactions d'HSR du type cytotoxique s'exercent généralement à l'encontre des
antigènes portés sur la membrane de cellules vivantes, et, comme celà sera revu
ultérieurement, jouent donc un rôle important dans les réactions de défense
contre les infections virales, dans les réactions de rejet d'allogreffe et de
défense anti-tumorale, ainsi que dans certaines maladies auto-immunes
(hépatites, diabète insulinodépendant, encéphalite AI expérimentale, etc...).
Les lymphocytes T sensibilisés et activés spécifiquement produisent des cytokines diverses, et notamment de l'IFN-g, qui induisent la génération de lymphocytes T cytotoxiques (CTL : cytotoxic T lymphocytes) capables de reconnaître spécifiquement les antigènes portés par les cellules étrangères (greffes) ou anormales (cellules infectées par des virus, cellules tumorales), et de détruire ces cellules.
Histologiquement,
l'infiltrat cellulaire qui caractérise les réactions d'HSR du type cytotoxique
est donc essentiellement constitué de lymphocytes T qui, pour la moitié
environ, sont du type helper/inducteur (Lyt-1+, chez la souris ; CD4+, dans
l'espèce humaine), et, pour la moitié restante, du type cytotoxique (Lyt-2,3+,
chez la souris ; CD8+, chez l'homme).
Cependant, des cellules naturelles cytotoxiques (cellules NK ou natural killer) peuvent également être retrouvées au sein de cet infiltrat, notamment pendant les premiers jours de la réaction. Les résultats de certains travaux récents ont permis de démontrer que ces cellules n'étaient pas directement responsables de la destruction des cellules cibles, et permettent de penser qu'elles stimulent la génération et l'activation des CTL en produisant de l'IL-2 et de l'IFN-g.
IV - Réactions d'HSR à basophiles (et/ou
à mastocytes)
A)
Aspects histologiques
Histologiquement, ces réactions sont caractérisées par un
infiltrat comportant 50 à 60 p.cent de basophiles (ou de mastocytes), les
autres cellules étant principalement des lymphocytes T helper.
B)
Implications cliniques et
expérimentales
Chez l'animal: des réactions d'HSR cutanée à basophiles (CBH : cutaneous basophil
hypersensitivity) ont pu être induites expérimentalement chez le cobaye par
l'injection, dans des conditions très précises (voie épicutanée, dose faible,
administration simultanée d'adjuvant), d'antigènes de nature protéique.
Des
réactions similaires, mais où prédominent les mastocytes, sont observées au
cours de certaines maladies auto-immunes comme l'uvéite AI induite chez le rat.
Dans l'espèce humaine : des réactions ressemblant étroitement aux réactions de
CBH décrites chez l'animal sont observées en clinique humaine pendant la phase
de début des dermites (eczémas) de contact et certaines urticaires chroniques.
Un infiltrat riche en mastocytes et en lymphocytes T est observé dans certaines
réactions de rejet d'allogreffe et de défense anti-tumorale, dans certaines
maladies auto-immunes (arthrite rhumatoide) et dans certaines réactions du
greffon contre l'hôte.
C) Mécanismes
immunologiques
Ce sont les études expérimentales in vitro qui ont permis
de comprendre les mécanismes intimes impliqués dans ces réactions d'HSR un peu
particulières, au cours desquelles les lymphocytes Th1 spécifiquement activés
par l'antigène libèrent des cytokines qui contribuent à recruter et à activer
les basophiles ou les mastocytes au niveau de la réaction d'HSR (GM-CSF, IL-3
et IL-4, notamment).
D) Fonctions
des basophiles et des mastocytes
Le rôle joué par ces cellules dans les réactions d'HSR a
pu être démontré grâce aux travaux menés depuis plusieurs années, notamment
chez les souris génétiquement dépourvues de mastocytes (W/Wv), chez qui la
réaction inflammatoire précoce fait complètement défaut, et chez qui
l'intensité de la réaction plus tardive est significativement diminuée, bien
que ces résultats soient contestés par certains.
De
plus, les antihistaminiques H1 (cimétidine) et les anti-sérotonine
(methysergide, kétansérine) inhibent de façon significative l'expression des
réactions d'HSR cutanées et pulmonaires chez l'animal.
Fonctions effectrices : les basophiles et les mastocytes, recrutés et activés
par les mécanismes évoqués précédemment, libèrent localement des médiateurs
vaso-actifs et pro-inflammatoires (histamine, sérotonine,
etc...). Cette libération s'effectue par vagues successives, dont la première
(entre la 1ère et la 6ème heure) correspond à la phase précoce de la réaction ;
la seconde se situe aux alentours de la 24ème heure, et la dernière peu avant
la 48ème heure. Les médiateurs ainsi libérés, notamment au cours des deux
premières vagues, induisent une augmentation de la perméabilité capillaire qui
favorise l'afflux local des lymphocytes T et des basophiles ou
des mastocytes, eux-mêmes engagés dans la réaction d'HSR.
En
outre, l'augmentation de la perméabilité capillaire induite par ces médiateurs
est probablement responsable de la spongiose et de la formation des vésicules,
dans les eczémas de contact et les urticaires chroniques.
Par
ailleurs, les mastocytes et, à un moindre degré, les basophiles, sont doués de
propriétés phagocytaires et cytotoxiques , et, à ce titre, pourraient
jouer un rôle analogue à celui joué par les cellules monomacrophagiques au
cours des réactions d'HSR classiques.
Fonctions immunomodulatrices : il semble bien, également, que les mastocytes et
les basophiles engagés dans les réactions d'HSR jouent un rôle modulateur sur
l'expression de ces réactions.
Les
résultats d'études réce,tes ont montré que, in vitro, les mastocytes murins en
culture pouvaient présenter des antigènes divers aux lymphocytes T ; il se
pourrait donc qu'il en soit de même in vivo, d'autant que les mastocytes
produisent également des cytokines immunostimulantes diverses, et notamment de
l'IL-1. Par ailleurs, l'histamine libérée par les mastocytes et les basophiles
pourrait activer des lymphocytes T "contrasuppresseurs" (effets de
type H1), et, par là-même, amplifier la réponse IMC.
D'autre
part, les mastocytes et les basophiles pourraient également jouer un rôle
modérateur sur l'expression des réactions d'HSR, en produisant, après la 48ème
heure, certains médiateurs doués de propriétés immunodépressives et
anti-inflammatoires , comme les prostaglandines (PGE2), le LTB4,
l'histamine (effets H2) et la sérotonine.
V - IMC, HSR et pathologies
Des
déficits de l'IMC sont observés fréquemment en pathologie courante; les
caractéristiques propres à ces déficits ont déjà été évoqués ou le seront dans
d'autres chapitres, et l'on se bornera ici à étudier les maladies qui résultent
d'une sensibilisation de type cellulaire et de réactions d'HSR (à l'exception
des maladies auto-immunes).
A)
Les dermites (eczémas) de contact
ces affections cutanées sont déclenchées par le contact
répété de la peau avec des substances le plus souvent non immunogéniques
(haptènes), mais qui acquièrent leur pouvoir sensibilisant et déclenchant en se
combinant avec des macromolécules de la peau. Ces substances sont extrèmement
variées, et très répandues dans l'environnement, professionnel ou non : il peut
s'agit de médicaments (pénicilline par exemple), de substances chimiques,
minérales (nickel, chrome présents dans la poudre de ciment et certains bijoux
ou accessoires vestimentaires), ou végétales (sèves d'arbres, primevère,
etc...).
Cliniquement,
s'associent érythème, vésiculation et prurit, dans les formes aiguës. L'aspect
histologique des lésions est caractérisé par une vésicule creusée en plein
épiderme, et par un infiltrat dermo-épidermique, tout d'abord riche en cellules
mononucléées et en basophiles (réaction de CBH), puis qui évolue
progressivement pour prendre l'aspect d'une réaction d'HSR classique (infiltrat
mononucléé constitué de lymphocytes T, de cellules monomacrophagiques et de
cellules de Langerhans).
B)
Maladies diverses
Les urticaires chroniques : il s'agit d'urticaires récidivantes, dont chaque
épisode est caractérisé par une durée anormale (plusieurs semaines parfois), et
dont l'étiologie reste le plus souvent obscure.
Les
biopsies révèlent la présence de lymphocytes T (CD4+) et de nombreux basophiles
ou mastocytes. La concentration de la peau en histamine est augmentée. Ces aspects
permettent donc d'assimiler, au moins dans une certaine mesure, les réactions
d'urticaire chronique à des réactions d'HSR cutanée à basophiles/mastocytes.
Les allergies microbiennes, mycobactériennes et fungiques : la plupart des allergies
microbiennes (streptocoque notamment), mycobactériennes (BK et tuberculine) et
fungiques (Candida albicans) se traduisent par des manifestations d'HSR
cutanées (érythème noueux, érésypèle, acné pustuleuse ou rosacée, certaines
urticaires et oedème de Quincke, eczéma), oculaires (uvéites et conjonctivites
chroniques; atteintes rétiniennes parfois), et articulaires.
Comme celà a déjà été évoqué plus
haut, elles ne relèvent pas, en principe, de la désensibilisation spécifique.
Allergies médicamenteuses : certaines réactions allergiques aux médicaments correspondent à une réaction d'HSR. Il s'agit notamment des eczémas de contact ou par ingestion (anesthésiques locaux; antiseptiques locaux contenant des ammoniums quaternaires; b-lactamines; sulfamides; néomycine; antihistaminiques H1) et des réactions de photosensibilité (photodermatoses dues à l'acide nalidixique, aux tétracyclines, aux phénothiazines et à la chlorpromazine, etc...).
C)
Relations entre HSR et allergie immédiate
Introduction (arguments fournis par la dermatite atopique) : l'existence de relations entre
HSR et allergie immédiate a été évoquée depuis longtemps. En effet, la
dermatite atopique (DA ou eczéma constitutionnel) est bien souvent la
manifestation initiale d'une allergie immédiate ; les taux d'IgE sériques
totales y sont généralement élevés ; les tests cutanés à lecture immédiate
(prick-tests, IDR) et les RAST-IgE pour les allergènes courants (poussière et
ses acariens ; trophallergènes divers ; pollens parfois) y sont fréquemment
positifs ; enfin, dans plus de 30 p.cent des cas, se développent ultérieurement
des manifestations d'allergie immédiate authentiques, respiratoires (rhinite,
asthme) ou/et oculaires (conjonctivite, blépharoconjonctivite).
Or,
histologiquement, la DA est caractérisée par des lésions d'HSR typiques,
comportant un nombre élevé de lymphocytes T (CD4+), de cellules
monomacrophagiques et de cellules de Langerhans. D'autre part, une importante
augmentation du nombre des mastocytes est couramment observée dans la peau des
sujets atteints de DA, en particulier pendant les poussées aiguës et dans les
formes chroniques lichénifiées.
Le
rôle joué par l'IMC dans la pathogénie de la DA est étayé par les résultats de
certaines études in vitro, qui ont permis de démontrer que les réponses IMC
dirigées contre certains (auto-)antigènes cutanés (cellules cutanées, sueur)
étaient exacerbées chez les patients atteints de DA ; cette hyperréactivité
résulte probablement d'un déficit fonctionnel des lymphocytes T suppresseurs
impliqués dans le maintien de la tolérance pour les auto-antigènes, comme
permettent de le suggérer les anomalies observées en culture lymphocytaire
mixte autologue (AMLR : autologous mixed lymphocyte reaction). Enfin, comme
celà sera revu plus loin, les tests cutanés à lecture retardée aux allergènes
courants (pneumallergènes, trophallergènes) sont couramment positifs, non
seulement en réponse immédiate (voir plus haut), mais aussi en lecture retardée
(patch-tests, IDR).
Paradoxalement,
il existe, chez les sujets atteints de DA, un déficit de l'IMC dirigée contre
les antigènes bactériens, mycobactériens (anergie ou hypoergie tuberculinique)
et fungiques. L'origine de ce déficit n'est pas claire ; cependant, elle
pourrait correspondre à une hyperactivation de certains lymphocytes T
suppresseurs, soit par de l'histamine (effets H2), soit/et par des
prostaglandines dont la production serait stimulée par des taux élevés d'immuns
complexes circulants. Quoiqu'il en soit, ces divers déficits pourraient
expliquer la sensibilité accrue des atopiques aux infections (virales et
bactériennes notamment), ces infections pouvant par ailleurs déclencher ou
exacerber les poussées de DA (cf. Chap. Allergie immédiate).
Certaines
autres observations, faites chez les patients atteints de manifestations
allergiques du type immédiat, permettent également de confirmer l'existence de
relations entre HSR et allergie immédiate : ainsi, on observe couramment un
infiltrat riche en lymphocytes T (CD4+) durant la phase tardive des réactions
d'allergie immédiate, ainsi qu'une augmentation significative de la proportion
des lymphocytes T activés (lymphocytes CD4+ exprimant des antigènes
d'histocompatibilité de classe II et des récepteurs pour l'IL-2) dans le sang
des sujets atteints d'asthme sévère.
Rôle des cytokines dans l'expression des manifestations d'HS immédiate : comme celà a déjà été
évoqué (cf. HSR à basophiles et/ou à mastocytes), certaines
cytookines exercent des effets mitogéniques, chimiotactiques et
activateurs sur les basophiles et les mastocytes.
La
production de ces cytokines a pu être obtenue en stimulant les lymphocytes de
sujets normaux par des mitogènes non spécifiques (PHA, Con.A) ou par certains
antigènes (streptokinase-streptodornase d'origine streptococcique; candidine;
etc...), et les conditions de libération de ces cytokines permirent tout
d'abord de suggérer qu'elles jouaient un rôle important dans les réactions
d'HSR ( réactions de Jones-Mote notamment).
Cependant,
l'hypothèse selon laquelle elles pouvaient également participer activement aux
réactions allergiques du type immédiat fut ultérieurement étayée par un certain
nombre d'observations. Ainsi :
- in
vitro, les cellules mononucléées sanguines des atopiques produisent des
quantités anormalement élevées de cytokines stimulant la croissance et la
différenciation des basophiles (IL-3 ; GM-CSF) ; soit spontanément, soit après
stimulation par la PHA, les acariens ou certains antigènes bactériens, elles
libèrent également des lymphokines exercant des effets histaminolibérateurs ou
potentialisant la dégranulation IgE-dépendante des basophiles et des mastocytes
(HRF, IL-2) ;
- in
vivo, du HRF a pu être détecté localement, dans les réactions allergiques du
type immédiat (rhinites entre autres), et le pic de production du HRF coincide
avec le pic tardif de libération d'histamine ; cette production de HRF
s'accompagne par ailleurs d'un déficit de la production du HRIF (histamine
release-inhibitory factor), comme celà a été montré dans le liquide de lavage
broncho-alvéolaire de patients asthmatiques. Ces anomalies sont dans l'ensemble
assez bien corrélées avec la sévérité de la maladie (DA, asthme), et sont
corrigées par la désensibilisation spécifique ;
- in
vivo, le HRF induit une dégranulation des basophiles et des mastocytes, qui se
traduit par une réaction urticarienne lorsqu'il est injecté par voie
intradermique, ou par un bronchospasme lorsqu'il est administré par inhalation.
Ces résultats confirment ceux de travaux antérieurs, qui avaient démontré que
les surnageants de cultures de lymphocytes provenant de sujets asthmatiques
étaient capables d'induire une réaction urticarienne, lorsqu'ils étaient
administrés, par voie ID, à des sujets non allergiques.
Rôle des IgE dans l'HSR : on a démontré que les IgE pouvaient jouer un certain rôle
dans les réactions d'HSR, notamment dans la dermatite atopique et dans les
réactions d'HSR cutanée à basophiles.
Ainsi,
chez les sujets atteints de DA, des IgE sont fixées, par leur fragment Fc, sur
la membrane des cellules de Langerhans et des autres cellules dendritiques de
l'épiderme, essentiellement au niveau des lésions, mais aussi en peau saine. Il
semble que ces anticorps favorisent la captation des allergènes de
l'environnement (poussière et acariens, antigènes microbiens, voire pollens)
par les cellules de Langerhans et les cellules dendritiques, et puissent ainsi
induire ou exacerber la réaction d'HSR qui caractérise la dermatite atopique ;
cette hypothèse est étayée par le fait que les poussées de DA sont fréquemment
déclenchées ou aggravées par l'exposition aux allergènes et par les
surinfections cutanées.
On
a également démontré que des IgE étaient fixées sur les mastocytes cutanés des
patients atteints de DA et, chez l'animal, qu'elles pouvaient se fixer sur les
basophiles infiltrant les réactions de CBH et sur les mastocytes présents dans
certaines réactions de rejet de greffe ou de défense anti-tumorale (tumeurs
expérimentales). In vitro, lors de l'exposition à l'antigène, ces IgE peuvent
induire une dégranulation des basophiles et des mastocytes, qui libèrent alors
des médiateurs chimiotactiques et activateurs pour les autres cellules
impliquées dans la réaction d'HSR. Cette observation est à rapprocher du fait
que, chez les sujets atteints de DA, les tests cutanés pratiqués avec des allergènes
courants sont fréquement positifs, non seulement en lecture immédiate
(10ème-15ème minute), mais aussi en lecture retardée (48ème-72ème heure).
Les
résultats d'une étude expérimentale récente ont confirmé que les IgE pouvaient
jouer un rôle dans la pathogénie des réactions d'HSR, en démontrant que
l'injection IV de faibles quantités d'IgE spécifiques (incapables à
elles-seules d'initier une réaction d'HSI) était capable d'initier une réaction
(cutanée) d'HSR chez des souris préalablement sensibilisées, et recevant par
voie intradermique l'antigène correspondant.
IV – Méthodes d’étude de l'IMC/HSR
A)
Méthodes in vivo
Tests cutanés à lecture retardée : in vivo, la détection des sensibilisations de type
cellulaire repose avant tout sur la pratique des tests cutanés à lecture
retardée (lecture à la 48ème-72ème heure). On dispose de quatre types de tests
:
- la
cutiréaction, par scarification, imprécise et exposée à des erreurs par excès
ou par défaut, et actuellement abandonnée ;
- la
bague multipuncture (monotest), plus précise, mais parfois difficile à lire ;
- les
intradermoréactions (IDR), qui consistent à injecter par voie ID 0,02 à 0,03 ml
de la solution/suspension antigénique ; il s'agit du test de référence, à
préférer dans tous les cas ;
- les
tests épicutanés (épidermotests, patch-tests), utilisés pour le diagnostic des
eczémas de contact : ils consistent à appliquer, sur la peau normale ou
légèrement abrasée, l'antigène maintenu sous pansement occlusif pendant 48
heures.
Ces
tests sont considérés comme positifs si l'on constate, à la 48ème-72ème heure :
- en
cas de cuti ou de bague multipuncture, une induration palpable de plus de 2 mm
de diamètre ;
- en
cas d'intradermoréaction, une induration palpable de plus de 5 ou 6 mm de
diamètre ;
- en
cas d'épidermotest, une réaction eczémateuse sur la surface d'application.
La
positivité du test permet d'affirmer qu'il existe bien une immunité à médiation
cellulaire spécifique de l'antigène testé, mais elle ne permet généralement pas
d'affirmer avec certitude (sauf pour les patch-tests, dans les eczémas de
contact) que cette sensibilisation est responsable des symptômes observés.
Aussi, la survenue d'une réaction syndromique (parfois d'amélioration, le plus
souvent de déclenchement/aggravation des symptômes) vers la 48ème heure suivant
l'administration de l'antigène est un argument de grande valeur pour le
diagnostic étiologique des allergies (microbiennes notamment) de type retardé.
Toutefois,
la recherche d'une réaction syndromique est formellement contre-indiquée
lorsqu'un organe vital est en jeu (atteinte des tuniques internes de l'oeil,
tout particulièrement).
Les
tests cutanés à lecture retardée sont couramment utilisés pour l'étude :
-
de
la réactivité à la tuberculine (tests tuberculiniques) ;
- des
allergies microbiennes, aux moisissures, aux champignons et aux levures, voire
de certaines allergies parasitaires ;
- des
eczémas de contact (patch-tests aux produits de beauté, substances terpéniques,
métaux divers, cuirs, nylons, etc...) ;
- des
déficits de l'IMC (tests à la tuberculine, à la candidine, au DNCB ou au DNFB).
Dans ce cas, l'intradermoréaction à la PHA peut également être pratiquée, mais
elle a une signification toute différente : la réaction inflammatoire locale
observée ne correspond pas à une "allergie" à la PHA, mais à une
prolifération et une activation locales des lymphocytes T; in vivo, elle
réalise l'équivalent de la réponse in vitro à ce même mitogène (voir plus loin).
Tests de provocation : ils consistent à reproduire les symptômes d'HSR, en
réintroduisant dans l'organisme l'antigène suspecté. On peut classer dans cette
catégorie de tests les patch-tests utilisés pour le diagnostic
étiologique des eczémas de contact, puisqu'ils visent à reproduire une lésion
d'eczéma, en appliquant l'antigène directement sur la peau (voir plus haut).
Les
autres tests de provocation (par voie nasale, bronchique, digestive, voire
oculaire), qui sont couramment utilisés pour le diagnostic étiologique des
allergies de type immédiat, ont une place réduite dans l'exploration des HSR.
B)
Méthodes d'étude in vitro
in
vitro, à part la numération des lymphocytes T et de leurs diverses
sous-populations, l'exploration de l'IMC et de l'HSR repose essentiellement sur
des tests fonctionnels. Il s'agit :
du test de transformation lymphoblastique, qui consiste à étudier, soit par
méthode optique, soit par méthode radioisotopique (incorporation de thymidine
tritiée), la réponse proliférative des lymphocytes T, après qu'ils aient été
activés.
L'exploration
des états d'HSR repose sur l'étude de la réactivité des lymphocytes T aux
antigènes spécifiques incriminés; lorsque l'antigène est ajouté au milieu de
culture, les lymphocytes T helper/inducteurs préalablement sensibilisés in vivo
reconnaissent alors l'antigène, et se transforment en lymphoblastes qui donnent
naissance à de nouveaux lymphocytes. Cependant, l'interprétation de ce test est
délicate, dans la mesure où un test positif signifie bien que le sujet est
sensibilisé par l'antigène testé, mais ne permet pas d'affirmer que la
sensibilisation ainsi détectée est à l'origine des symptômes.
L'exploration
des déficits de l'immunité cellulaire repose, quant à elle, sur l'étude de la réactivité
lymphocytaire aux mitogènes (PHA, Con.A), en culture mixte lymphocytaire, et à
certains antigènes courants (tuberculine ou PPD, candidine,
streptokinase-streptodornase, etc...).
de tests objectivant indirectement la production de cytokines : activés par les antigènes ou
les mitogènes, les lymphocytes T libèrent des cytokines dont la production peut
être étudiée in vitro par diverses méthodes, parmi lesquelles :
-
le test de la migration leucocytaire (TML), en un temps, où lymphocytes et
leucocytes sont incubés en même temps en présence de l'antigène. Les cytokines
produites par les lymphocytes T spécifiquement sensibilisés et activés (LIF,
MIF) exercent alors leurs effets sur les leucocytes, dont elles inhibent la
migration, dans une chambre en verre à fond plat ;
-
le test d'inhibition de la migration des leucocytes (TIML) et le test
d'inhibition de la migration des macrophages péritonéaux de cobaye (TIMMPC) :
il s'agit de tests en deux temps, qui consistent à recueillir le surnageant de
cultures lymphocytaires, et à tester l'activité inhibitrice de ce surnageant
sur la migration des leucocytes humains (TIML) ou des macrophages péritonéaux
de cobaye (TIMMPC) ;
-
le test de l'agglutination leucocytaire, en un temps, qui consiste à incuber en
même temps les leucocytes et les lymphocytes sanguins avec l'antigène. Comme
dans le cas du TML, les lymphocytes T spécifiquement sensibilisés et activés
produisent des cytokines (LAF, MAF) qui induisent une agglutination des
leucocytes.
du test de cytotoxicité lymphocytaire (CMC : cell-mediated lympholysis)
enfin, qui permet l'étude des propriétés fontionnelles des lymphocytes T
cytotoxiques en présence de cellules allogéniques marquées par un
radio-isotope.
Figure 1 : structure des IgE
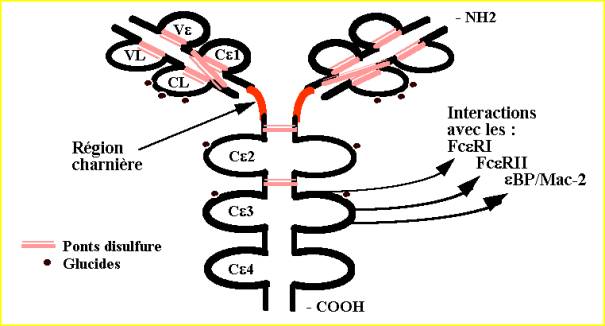
Abréviations :
CL (domaine constant des chaînes légères) VL (domaine variable des chaînes légères)
Ce (domaines constants des chaînes e) Ve (domaine constant des chaînes e)
FceRI (récepteur de forte affinité pour les IgE FceRII (récepteur de faible affinité pour les IgE)
eBP/Mac-2
(e-binding protein)
Figure 2 : mécanismes régulant la
synthèse des IgE
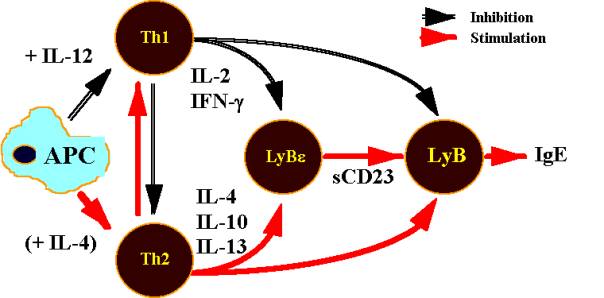
Figure 3 : conception classique de la réaction allergique du
type immédiat
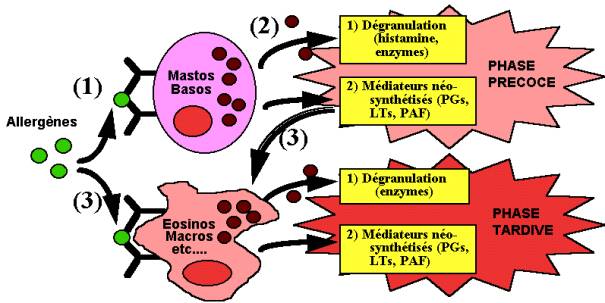
Abréviations : LTs (leucotriènes)
PAF (platelet-activating factor)
PGs (prostaglandines)
Figure 4 : conception actuelle de la phase tardive de la
réaction allergique du type immédiat
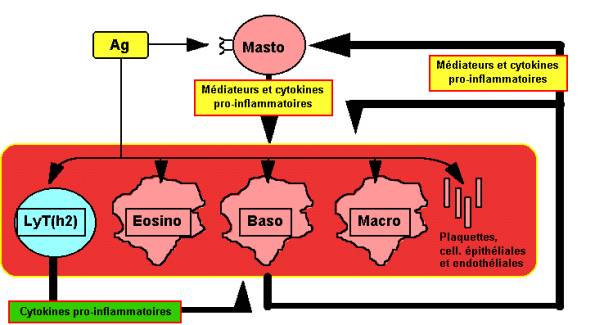
Figure 5 : conceptions actuelles sur
les anomalies immunologiques de l’atopie
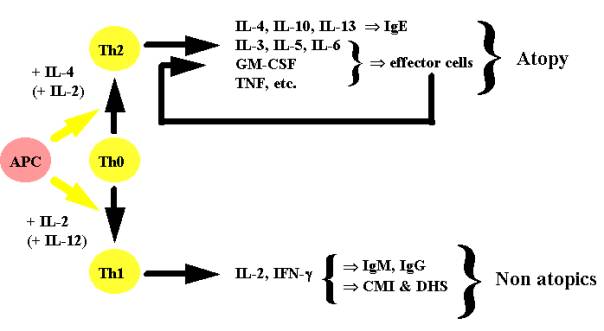
Figure 6 : mécanismes immunologiques
schématiques des réactions anaphylactiques et anaphylactoïdes
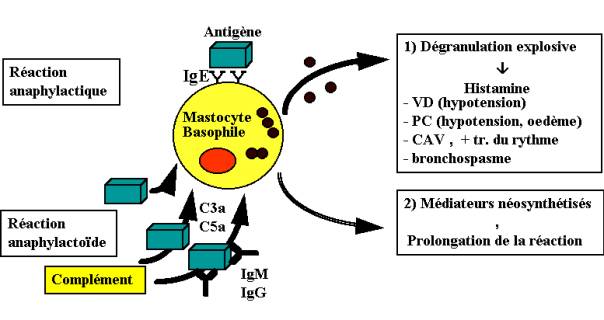
Figure 7 : anaphylaxie passive
généralisée in vivo
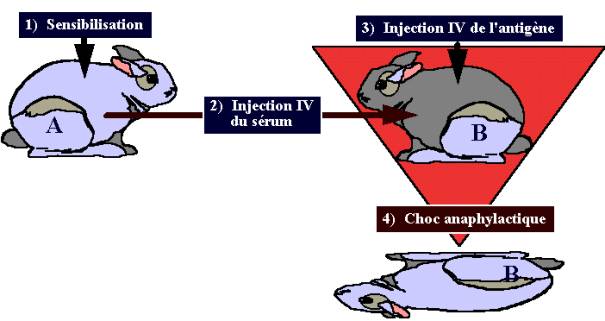
Tableau I : gènes (possiblement) associés à l'atopie

Tableau II : caractéristiques respectives des basophiles et des
mastocytes séreux et muqueux chez l'homme
|
||||
|
Caractéristiques |
Basophiles |
Mastocytes muqueux (T) |
Mastocytes séreux (TC) |
|
|
Localisation |
essentiellement sanguine |
muqueuses digestive et respiratoire |
tissu conjonctif, sous-muqueuse respiratoire
et digestive, péritoine |
|
|
Origine |
précurseurs médullaires de la lignée
granulocytaire |
précurseurs myéloïdes mononucléés localisés
dans la moelle osseuse, les tissus périphériques, et le sang |
||
|
Maturation et différenciation |
T-dépendante |
T-dépendante (IL-3, IL-4, IL-10) |
Facteurs micro-environnementaux (SCF) |
|
|
Cytologie : -forme -
diamètre -noyau -
membrane granulations |
irrégulière constant (10/15 m) polylobé régulière grosses (1m environ) métachromatiques (±) |
ronde variable (15/25 m) rond irrégulière petites (0,1 à 0,5 m) non métachrom/métachromatiques |
||
|
Contenu des granules -protéoglycans -histamine -sérotonine -enz. lysosomiales |
chondroitine sulfate 1pg/cellule (traces) (0 à ±) |
chondroitine sulfate 1 pg/cellule (traces) tryptase |
héparine sulfate 4 à 10 pg/cellule (traces) tryptase + chymase |
|
|
Médiateurs |
LTB4, LTC4PAF |
LTB4, LTC4PAF |
prostaglandines (PGD2) |
|
|
FceRI (nb) |
6 000 à 600 000 /cell. |
100
000 environ par cellule |
||
|
Dégranulation : -IgE-dépendante -Ca-ionophore -tachykinines (SP) |
oui (+) faible/nulle faible/nulle |
oui (++) faible/nulle faible/nulle |
oui (+++) oui (+++) oui (+++) |
|
|
Inhibiteurs : -cromoglycate -théophylline -corticoïdes -IFN-g -b-adrénergiques |
faible/nulle faible/nulle faible/nulle faible/nulle oui |
faible/nulle faible/nulle faible/nulle faible/nulle oui |
oui oui faible/nulle oui oui |
|
Abréviations :
IL-3, 4, 10 (interleukines 3, 4, 10)
LTB4, C4 (leucotriènes B4, C4) ;
PAF (platelet-activating factor)
PGD2
(prostaglandine D2)
SCF
(stem cell factor)
|
Tableau III : origine des principaux médiateurs de l'HSI |
||
|
Médiateurs et enzymes |
Intragranulaires (préformés) |
Néoformés (synthétisés |
|
Mastocytes |
histamine, ECFA, NCFA tryptase, chymase |
PGD2, PGF2a, TXs LTB4, LTC4, LTD4, LTE4 PAF |
|
Basophiles |
histamine, NCFA, ECFA |
PGD2, PGF2a, TXs |
|
Eosinophiles et autres cellules |
MBP, ECP, EPO, EDN |
PGD2, PGF2a, TXs LTB4, LTC4, LTD4, LTE4 PAF |
Abréviations :
ECFA
(eosinophil chemotactic factor of anaphylaxis)
ECP
(eosinophil cationic protein)
EDN
(eosinophil-derived neurotoxin)
EPO (eosinophil peroxydase)
LT (leucotriènes)
MBP
(major basic protein)
PAF
(platelet-activating factor)
PG
(prostaglandines
NCFA
(neutrophil chemotactic factor of anaphylaxis)
TXs (thromboxanes)
|
Tableau IV : principales activités biologiques des médiateurs de
l'HSI |
||||||
|
Médiateurs |
Effets sur Vaisseaux Coeur Muscle lisse Epith. resp. Leucocytes |
|
||||
|
Histamine |
VD, PC ‰ |
Cond. AV Ê Rythme ‰ |
Contraction |
Mucus ‰ |
Chimiotactisme et activation |
|
|
PAF |
VD, PC ‰ |
Arythmie |
Contraction |
|
Chimiotactisme et activation |
|
|
PGF2a PGD2 TXA2 |
VD, PC ‰ |
|
Contraction Contraction Contraction |
|
Chimiotactisme Activation |
|
|
LTB4 SRSA (LTC4, D4 et E4) |
VD, PC ‰ |
Contraction Ê |
Contraction |
Mucus ‰ |
Chimiotactisme et activation Activation (±) |
|
Abréviations :
Cond. AV (conduction auriculo-ventriculaire)
LT (leucotriènes)
PAF (platelet-activating factor)
PC (perméabilité capillaire
PG (prostaglandines)
SRSA
(slow-reacting substance of anaphylaxis)
TX (thromboxanes)
VD (vasodilatation)
|
Tableau V : principales cytokines
impliquées dans les réactions d’HSI |
|
|
Cytokines |
Principaux effets
sur les cellules effectrices |
|
IL-1 |
- cofacteur de différenciation des PNE - potentialisation de l'histaminolibération - augmentation de la production d'IL-4 par les
LyTh2 |
|
IL-2 |
- production de facteurs éosinophilopoïétiques
par les MNCs des asthmatiques - chimiotactisme et activation des PNE - potentialisation de l'histaminolibération |
|
IL-3 |
- principal facteur de croissance des PNB et des
mastocytes (muqueux) - adhérence et activation des PNB et des
mastocytes - cofacteur de croissance des PNE - augmentation de l'expression du CD 23 sur les
mono-macrophages |
|
IL-4 |
- cofacteur de croissance et différenciation des
mastocytes - cofacteur de croissance et différenciation des
PNE - adhérence des mastocytes |
|
IL-5 |
- principal facteur de croissance et
(pré)activation des PNE - cofacteur de différenciation et activation des
PNB et des mastoctes |
|
IL-6 |
- chimiotactisme des PNE - potentialisation de l'histaminolibération |
|
IL-7 |
- préactivation des PNB et des mastocytes |
|
IL-8 |
- chimiotactisme et activation des PNB et des
mastocytes |
|
IL-9 |
- cofacteur de différenciation des mastocytes |
|
IL-10 |
- cofacteur de croissance des mastocytes - augmentation de l'expression du CD 23 sur les
mono-macrophages |
|
GM-CSF |
- chimiotactisme et activation des PNN, PNE et
macrophages - préactivation des PNB et des mastocytes |
|
IFN-g |
- cofacteur d'activation des mastocytes |
|
TNF-a/b |
- histaminolibération |
|
Tableau VI : étude des réactions anaphylactiques induites par l'injection IV d'anticorps anti-IgE chez les souris WBB6F1 et WCB6F1 (Martin et al, 1989) |
|||
|
Souris |
Rythme cardiaque (variation en %) |
Compliance dynamique (variation en %) |
Mortalité (%) |
|
WBB6F1 +/+ W/Wv |
+ 70 ± 15 non/peu modifié |
- 20 ± 5 non/peu modifiée |
50 0 |
|
WCB6F1 +/+ Sl/Sld |
+ 45 ± 10 non/peu modifié |
- 25 ± 5 non/peu modifiée |
71 0 |
|
Tableau VII : caractères distinctifs des réactions
allergiques du type immédiat, anaphylactiques, et anaphylactoïdes |
||||
|
Réaction |
Terrain prédisposant |
Sensibilisation Antérieure |
Mécanisme : Dégranulation |
Manifestations cliniques |
|
Allergique |
oui (terrain atopique) |
nécessaire |
dépendante des IgE |
DA, urticaire Rhinite, asthme Conjonctivite |
|
Anaphylactique |
non |
nécessaire |
dépendante des IgE |
Urticaire ± AO ± bronchospasme ± hypotension ± collapsus CV |
|
Anaphylactoïde |
non |
nécessaire non |
dépendante des IgM et/ou IgG directe |
Urticaire ± AO ± bronchospasme ± hypotension ± collapsus CV |
|
TABLEAU VIII : classification et chronologie des principaux pollens |
||
|
Origine |
Pollen |
Période |
|
Arbres |
noisetier (coudrier), aulne, bouleau peuplier, hètre, chène, érable, noyer platane, maronnier (±) troène, tilleul |
Février / Mars Mars / Avril Avril / Mai Juin / Juillet |
|
Graminées fourragères |
dactyle, phléole, paturin, agrostis, cynodon, flouve, ivraie, houlque, fétuque |
mi Mai-mi Juillet |
|
Céréales |
blé,
orge, avoine, maïs |
mi Mai -mi Juillet |
|
Herbacées |
plantain armoise pariétaire ambrosia |
Avril /Septembre fin Juillet/Octobre mi-Avril/mi-Oct.* Sept.-Oct.** |
|
* midi méditerranéen ** vallée du Rhone, région lyonnaise, Le Havre, Amérique du Nord |
||
TABLEAU IX : liste des aliments reconnus comme les plus allergisants
Protéines du lait de vache : b-lactoglobuline, a-lactoglobuline, caséines, albumine
Protéines de l'oeuf : blanc (ovalbumine, conalbumine, ovomucoïde) >>> jaune
Poissons, crustacés, mollusques
Graines comestibles : cacahuètes, amandes, noix, noisettes, etc...
Farines : blé, seigle, orge, soja, etc... >>> avoine
Nombreux fruits : agrumes notamment (orange, pamplemousse, etc...), mais aussi les bananes et les pommes (surtout la peau), considérées classiquement comme hypoallergéniques. A noter que les fruits mûrs sont moins allergisants que les fruits verts, et qu'il existe une antigénicité croisée entre la pomme et certains pollens d'arbres (bouleau notamment)
Nombreux légumes : petits pois, pois chiches, haricots, lentilles, ail, céleri (et sel de céleri)
Viandes : boeuf (antigénicité croisée evec le lait de vache) et veau >> porc >> poulet ; à noter que la viande de poulet est la moins allergisante
Figure 1 : méthode de dosage des IgE
sériques totales (principe du PRIST)
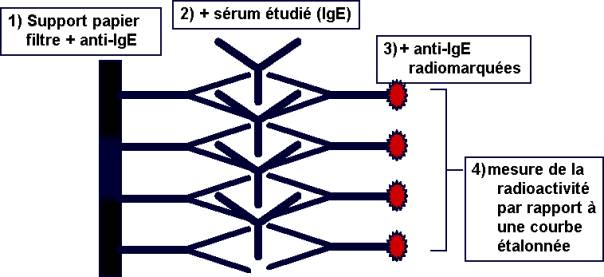
Figure 2 : interprétation du dosage des IgE
sériques totales
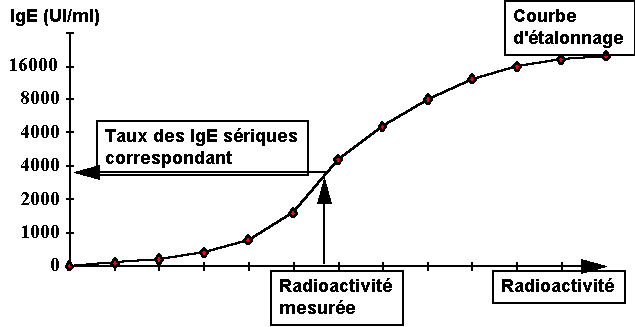
Figure 3 : principe des tests
multiallergéniques non quantitatifs de dépistage in vitro
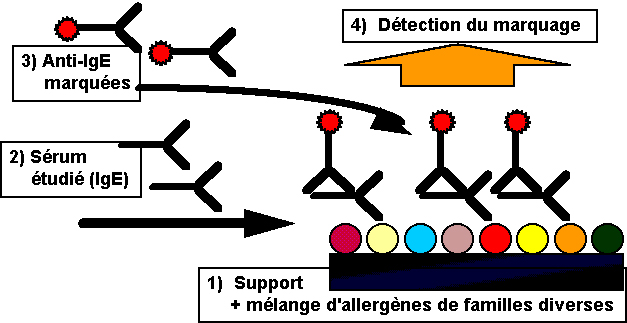
Figure 4 : principe des tests in vivo dans
l’allergie immédiate
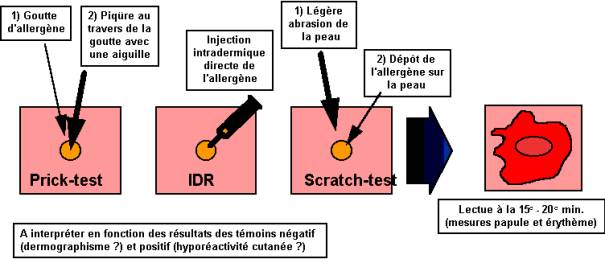
Figure 5 : principe des tests d’orientation
par groupes d’allergènes in vitro
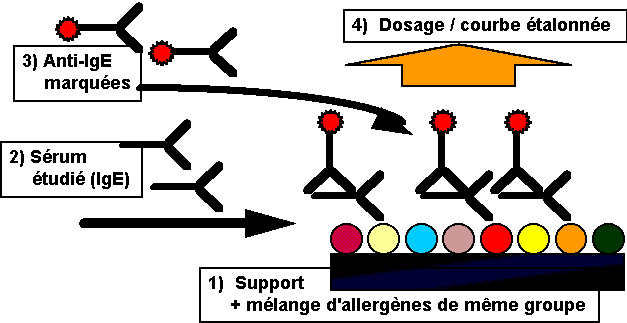
|
Table 1 : principaux tests in vitro d'orientation par groupes d'allergènes |
|
|
Tests |
Groupes d'allergènes étudiés |
|
Stallerscreen |
5 acariens 4 moisissures 4 phanères 3 plumes 5 arbres (pollens) 5 céréales (pollens) pollens de graminées + céréales + herbacées |
|
RAST alimentaires |
Fx2 (produits de la mer) Fx5 (aliments courants de l'enfant) Fx7 (légumes) Fx8 (fruits courants) Fx9 (fruits exotiques) Fx10 (viandes) |
Figure 6 : principe des tests
multiallergéniques in vitro à réponse quantitative par allergène
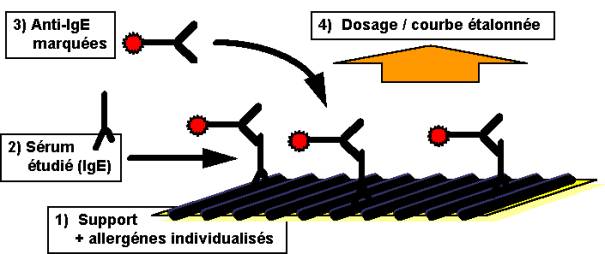
Figure 7 : principe du (CAP) RAST
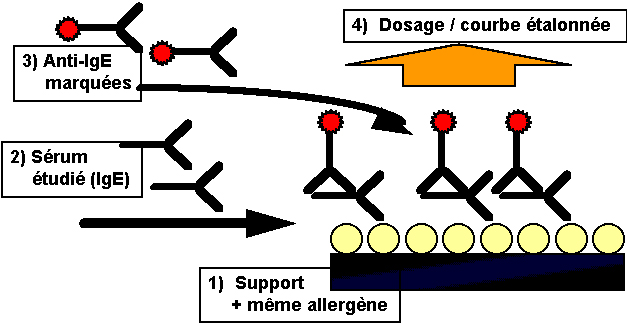
|
Tableau 2 : expression des résultats du CAP-RAST |
|
|
Classes |
Unités (PRU) |
|
0 1 2 3 4 5 6 |
< 0,35 0,35 à 0,70 0,70 à 3,5 3,5 à 17,5 17,5 à 50 50 à 100 > 100 |
Figure 8 : principes des tests
d’activation cellulaire in vitro
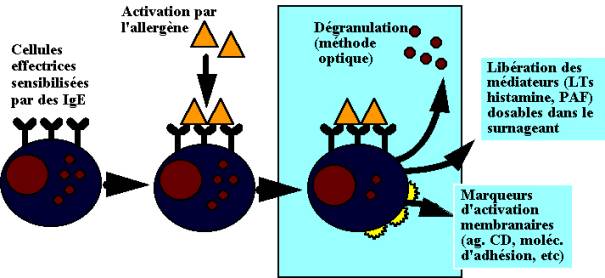
|
Tableau 3 : démarche diagnostique en allergologie |
||
|
Médecin |
Objectifs et méthodes |
Examens complémentaires |
|
Généraliste, pédiatre, pneumologue, dermatologue, allergologue |
Terrain atopique : interrogatoire : antécédents personnels et familiaux - évocateurs ........................... - incertains ............................ Diagnostic étiologique : interrogatoire |
inutiles NFS, IgE sériques
totales ou Phadiatop© IgE sériques spécifiques de groupes d'allergènes, éventuellement |
|
Allergologue seul |
Diagnostic étiologique : tests cutanés : - concordants .......................... - discordants .......................... |
inutiles RAST, tests multiallergéniques à réponse quantitative par allergène ; plus rarement tests d'activation cellulaire, et/ou tests de provocation |
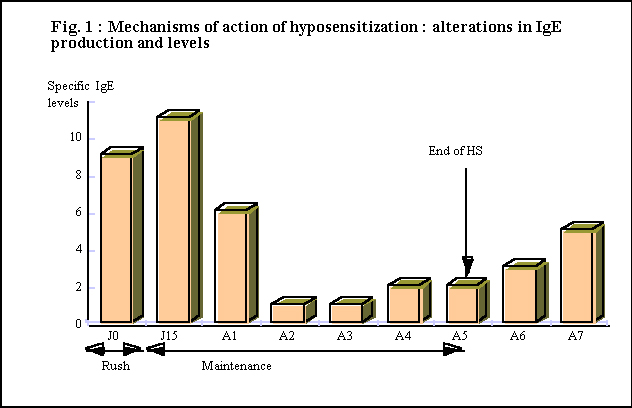
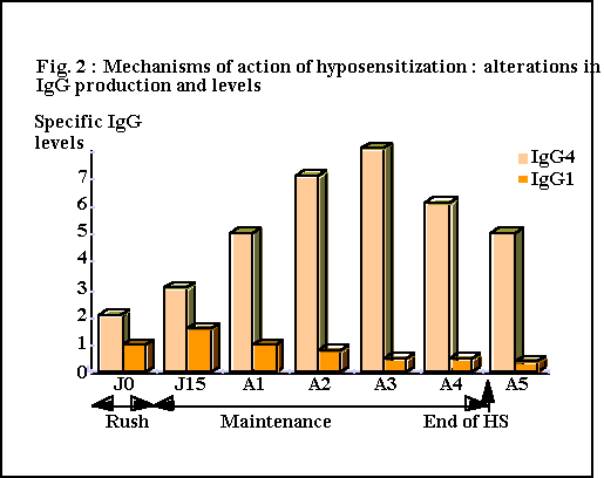
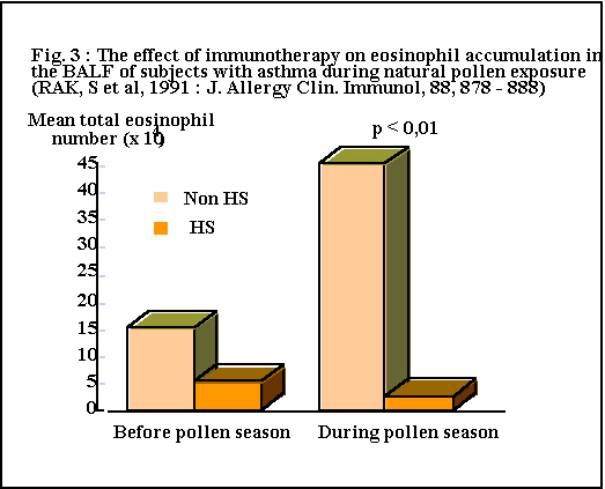
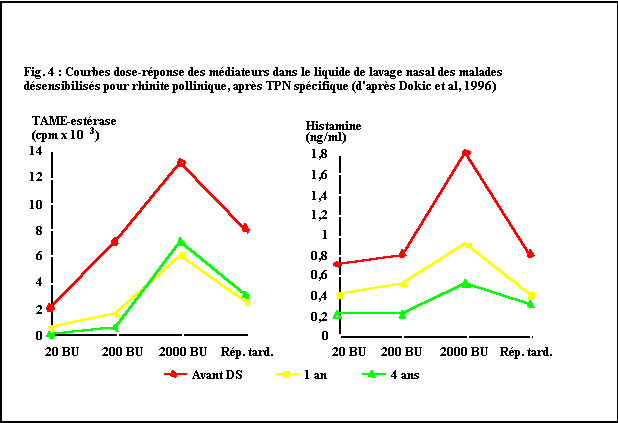
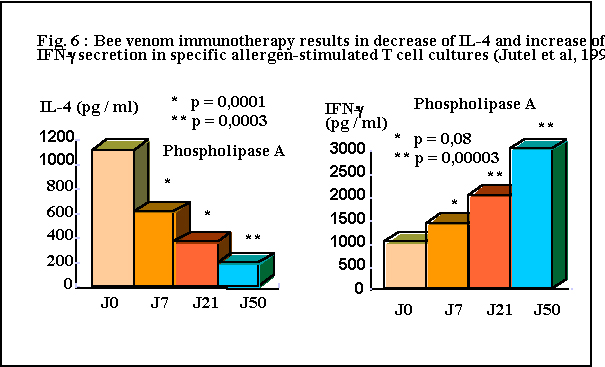
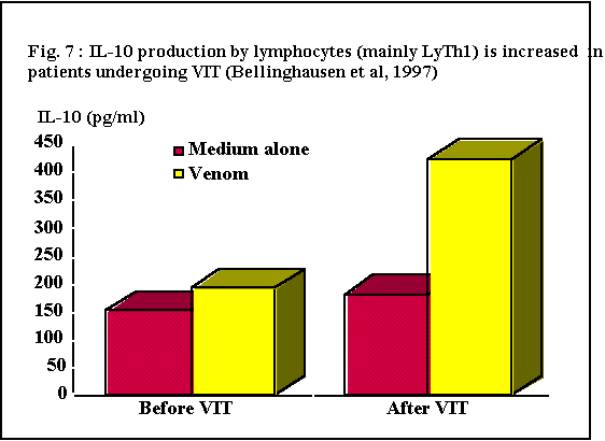
|
Tableau I : démarche diagnostique des bronchites dyspnéisantes récidivantes du nourrisson |
||
|
Interrogatoire policier |
Examen clinique |
Examens complémentaires systématiques |
|
Antécédents : - prématurité - ventilation néonatale - troubles du transit - dermatite atopique - accès de cyanose - stridor - toux aux liquides - âge et mode de début - chronologie des épisodes - état intercritique - tabagisme familial - crêche |
Recherche de : - hypotrophie - dermatite atopique - stridor - distension thoracique - cyanose - hippocratisme digital |
- radio thoracique - TOGD - test de la sueur - taux des IgM, G, A et E - examen ORL - a1-antitrypsine
|
![]() 4 situations
possibles :
4 situations
possibles :
|
Diagnostic fait |
Diagnostic évoqué |
Pas de diagnostic, mais manifestations peu préoccupantes |
Pas de diagnostic, mais manifestations préoccupantes |
|
- RGO - mucoviscidose - déficit en IgA - bronchodysplasie - anomalies des arcs aortiques - allergie |
- corps étranger inhalé - kyste bronchogénique de la carène - fistule oeso-trachéale - incoordination de la déglutition - maladie des cils - trachéomalacie poursuivre les examens en milieu hospitalier (endoscopie +++) |
surseoir (au
moins temporairement) à d'autres investigations |
poursuivre les investigations (endoscopie +++) |