![]()

Chapitre
2
LE
COMPLEXE MAJEUR DE PRESENTATION ET D'HISTOCOMPATIBILITE
I- Introduction
L'étude du Complexe Majeur d'Histocompatibilité (CMH) est placée sous le signe d'une dualité qu'il serait souhaitable d'indiquer dans le nom-même du complexe. Ce nom n'indique que l'une de ses propriétés, celle qui a permis sa découverte: la capacité d'induire une forte réponse immunitaire allogénique, particulièrement lors d’une greffe ou d’une transplantation. C'est cette propriété qui a été à l'origine de la découverte du CMH de la souris (Histocompatibility-2: H-2, B. Benacerraf) et de l'homme (Human Leukocyte Antigen: HLA, Jean Dausset), et qui en a permis l'étude grâce aux méthodes de l’immunogénétique. Seulement 30 ans plus tard sont apparus les premiers faits (Levine et al. 1963, Zinkernagel & Doherty. 1974) qui devaient conduire à l'élucidation de la fonction biologique naturelle du CMH: fonction de présentation de fragments d'antigènes (peptides) aux lymphocytes T. Toutefois il est clair que ces deux propriétés sont étroitement liées. C'est pourquoi on devrait préférer le terme Complexe Majeur de Présentation et d'Histocompatibilité (Colombani 1993) pour désigner les systèmes HLA, H-2, et les systèmes équivalents des vertébrés.
La fonction du système immunitaire est de surveiller le milieu intérieur, d'identifier les substances étrangères venues de l'environnement (microbes, substances organiques), ou dérivées du milieu intérieur lui-même (protéines mutantes, cellules tumorales), et de les éliminer. La reconnaissance se fait par référence à la constitution du milieu intérieur (self). Les structures d'identification dont dispose le système immunitaire adaptatif sont les anticorps produits par les lymphocytes B et les récepteurs des cellules T (TCR). L'identification est physico-chimique, dépendant de l'interaction d'une région limitée de la molécule de reconnaissance et d'une région limitée de la molécule étrangère (déterminant antigénique ou épitope). Les répertoires B (des anticorps) et T (des TCR) sont pratiquement illimités, capables de reconnaître une très grande diversité de structures étrangères. Les anticorps reconnaissent directement l'épitope approprié sur la molécule étrangère native, alors que les TCR ne peuvent reconnaître un peptide antigénique que lorsqu’il est présenté sur la membrane cellulaire par une molécule du CMH. Les TCR et les molécules du CMH forment ainsi un ensemble indispensable au fonctionnement normal du système immunitaire.
Le CMH peut donc être défini comme l'ensemble des molécules impliquées dans la présentation de peptides au TCR. Cette définition concerne les molécules présentatrices de l'antigène (" antigen presenting molecules ", APM), mais aussi d'autres molécules pouvant contribuer à la fonction de présentation. La définition fonctionnelle doit être complétée par la définition génétique du CMH: c'est la région chromosomique où se trouvent les gènes contrôlant la structure et l'expression des APM. Les deux définitions se complètent, mais doivent être nuancées. Il est en effet possible que les produits du CMH exercent d'autres fonctions que celle de présentation. D’autre part, parmi les nombreux gènes localisés dans le CMH, certains sont à l'évidence des gènes fortuitement associés, sans relation avec la fonction de présentation. D'autres, par exemple les gènes TAP (" Transporter of Antigen Peptides "), des TNF (" Tumor Necrosis Factors ") ou des HSP (" Heat Shock Proteins "), pourraient avoir une relation fonctionnelle avec le CMH. Inversement, certaines molécules participant à la fonction de présentation: b2-microglobuline (b2m), chaîne invariante (Ii), sont codées à l'extérieur du CMH.
Le CMH
est qualifié de complexe, parce qu'il est composé d'un ensemble de gènes
fonctionnant de manière coordonnée. Il existe d'autres antigènes
d'histocompatibilité en dehors du CMH. En effet, même lorsqu'une identité des
CMH est réalisée entre donneur et receveur de greffe, celle-ci est rejetée
(Counce et al. 1956). Les autres loci sont qualifiés de mineurs (Hmin), car le
rejet de greffe est généralement moins rapide qu'en cas d'incompatibilité pour
le CMH. De plus, on ne détecte pas d'anticorps reconnaissant les antigènes
Hmin. Le qualificatif " majeur " du CMH, est donc justifié
par l'intensité de la réponse.
Les gènes et produits du CMH sont répartis en trois classes, I, II, III (Klein 1986), selon leurs propriétés biochimiques, leur expression phénotypique et leur fonction. Les produits de classe I (CMH 1) sont des glycoprotéines composées d'une chaîne lourde (a) associée à la b2m, exprimées à la membrane de la presque totalité des cellules nucléées de l'organisme. Ils présentent un peptide endo-cellulaire aux lymphocytes T CD4+. Certains produits apparentés sont qualifiés de " classe I-like ".
Les produits de classe II (CMH 2) sont des glycoprotéines composées de deux chaînes a et b exprimées à la membrane des lymphocytes B, des monocytes-macrophages, des cellules dendritiques et de certaines cellules épithéliales après activation. Ils présentent un peptide, provenant d'une protéine extra-cellulaire ou membranaire endocytosée, aux lymphocytes T CD4+. Les produits de classe III sont les molécules C2, Bf et C4 du système du complément.
Le modèle décrit ci-dessous est le complexe HLA, le mieux connu avec le complexe H-2. L'étude d'autres espèces, incluant amphibiens, oiseaux, poissons primitifs, et mammifères indique la généralité du modèle HLA et l'extrême conservation du CMH.
II - Gènes HLA, Organisation, Evolution.
Le système HLA a d'abord été décrit comme un système immunogénétique à l'aide d'immunsérums reconnaissant un polymorphisme dans la population humaine. Des spécificités antigéniques (alloantigènes) ont été décrites à la membrane lymphocytaire par la technique de lymphocytotoxicité dépendante du complément: en présence de complément, lesanticorps spécifiques tuent la cellule porteuse de l'antigène correspondant. Des anticorps correspondant aux spécifités paternelles peuvent apparaître dans le sérum de femmes immunisées au cours de la grossesse par les cellules foetales. L'analyse de la réactivité de nombreux immun-sérums vis-à-vis des lymphocytes de la population humaine ("panel"), et de la transmission des diverses réactivités dans les familles, a permis la description de plusieurs séries alléliques: HLA-A, B, C, et DR. En raison du nombre élevé d'allèles (20 à 100) dans chaque série sauf la série C qui en comporte très peu, la plupart des individus sont hétérozygotes et leurs cellules sont porteuses d'une spécificité d'origine paternelle et d'une spécificité d'origine maternelle de chaque série; par exemple: HLA-A1, A2; B8, B 12; DR3, DR7. Le typage HLA de la famille d'un tel individu permet de définir son génotype, par exemple: HLA-A1, B8, DR3 / A2, B 12, DR7. Chaque ensemble A, B, DR constitue un haplotype transmis en bloc des parents aux enfants. Les exceptions à cette règle sont dues à de rares événements de recombinaison survenant avec une fréquence de 0,8 % entre les séries A et B, et avec une fréquence de 1% entre les séries B et DR. Les recombinaisons ont montré que le système HLA était composé de plusieurs loci distincts étroitement liés. La liaison à d'autres marqueurs, des études cytogénétiques, des expériences d'hybridation in situ ont localisé les gènes HLA sur le bras court du chromosome 6 (6p2l.3).
Les techniques de génétique moléculaire ont permis de construire une carte physique de la région HLA. La carte d'ensemble du complexe a été établie par la technique d'électrophorèse en champ pulsé (Figure 1). Les marqueurs HLA-A, B, DR, définis par les méthodes immunogénétiques, ont servi de points de repère à la carte physique. L'exploration systématique de la région HLA montre qu'elle contient 100 à 200 gènes dont certains sont identifiés. Cependant seulement 9 gènes de classe II et 3 ou 4 gènes de classe I fonctionnels codent les APM classiques. Des gènes de classe I-like et de classe II-like sont identifiés, dont l'expression ni la fonction ne sont connues. Les autres gènes sont soit des pseudogènes, soit des gènes fortuitement associés. Certains (TAP, LMP, TNF, HSP) pourraient avoir un lien fonctionnel avec les gènes des APM.
Figure 1 : Carte simplifiée du CMH humain, HLA.
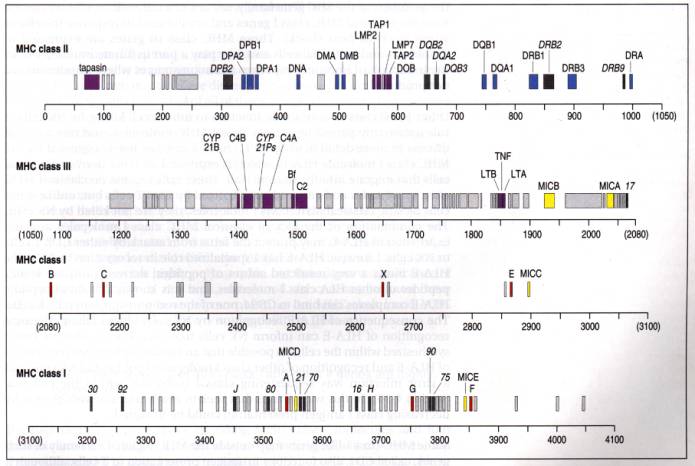
Photo :
Immunobiology, 1998, CA. Janeway. Ed Garland Publishing
Le complexe HLA est situé sur le bras court du chromosome 6 (6p2l.3). Il s'étend sur environ 3,5 Mb. Les gènes de classe 1 et de classe 2 codent les chaînes protéiques des molécules correspondantes. Trois molécules CMH 1, HLA-A,B,C sont exprimées à la membrane de la plupart des cellules nucléées de l'organisme. De nombreux autres gènes de classe 1 et classe 1-like (20 à 30) ont été identifiés. La plupart sont des pseudogènes; certains pourraient être exprimés en faible quantité et/ou seulement sur certains tissus. Les gènes de classe 2 codent les chaînes a (gènes A) (HLA-DRA, DQA1, DPA1) et b (gènes B) (HLA-DRB1, B3, B4, B5, DQB1, DPB1) des molécules de classe 2. Trois ou quatre molécules sont codées par un haplotype HLA: une molécule DP (gènes DPA 1 et DPB 1), une molécule DQ (gènes DQA 1 et DQB 1) et une ou deux molécules DR. Une première molécule DR (gènes DRA et DRB 1) est toujours exprimée. Une deuxième molécule DR ne l'est pas toujours (gène DRA et gène DRB3, B4 ou B5). Dans certains haplotypes HLA il n'y a pas de deuxième gène DRB fonctionnel et donc pas de 2ème molécule exprimée. DMA et DMB codent une molécule CMH2 non classique impliquée dans l’apprêtement de l’antigène.
De nombreux autres gènes sont associés aux gènes codant les molécules HLA membranaires. Les gènes de classe III codent trois (C2, Bf, C4) des quelques 20 facteurs du complément, système de défense immunitaire non spécifique. CYP21 (cytochrome P450, 21-hydroxylase) code une enzyme intervenant dans le métabolisme des corticoïdes surrénaliens. CYP21B est le gène fonctionnel, CYP21A est un pseudogène HSP70-1 et 2, codent deux protéines (Heat Shock Protein) protectrices des protéines cellulaires lors du stress. Elles semblent jouer le rôle de protéines chaperones lors de l'assemblage des molécules CMH 1 et 2 (Fig. 6). TNFA code le TNF-a (cachectine), cytokine produite par les monocytes et macrophaces. Douée d'activité lytique elle augmente l'expression des gènes HLA de classe 1 et 2. TNFB code le TNF-b (lymphotoxine), cytokine proche de TNF-a, mais distincte, produite par les lymphocytes T.
TAP 1 et 2 codent deux protéines
homologues de 808 ac. aminés. Chaque protéine comporte une "ATP binding
cassette". Elles s'associent pour former un hétérodimère (TAP:
"Transporter of Antigen Peptides") constituant une pompe à peptides
insérée dans la membrane du réticulum endoplasmique (Fig-6). LMP-2 et –7 codent
deux des protéines constituant le protéasome (LMP : "Large Multifunctional
Protease"), structure protéolytique présente dans le cytosol.
Plus de 100 gènes sont
actuellement répertoriés dans le complexe HLA. Environ 40 d'entre eux sont des
gènes ou pseudogènes de classe 1 ou 2. Parmi les autres gènes certains
seulement sont identifiés. La plupart sont sans lien structurel ou fonctionnel
avec le CMH (Trowsdale et al. 1991).
La
structure des gènes et l'organisation du chromosome CMH sont très anciennes,
puisqu’elles sont conservées chez tous les vertébrés, incluant de nombreux
mammifères, un oiseau (poule), un amphibien (xénope) et des poissons. L'ancêtre
du CMH est apparu en même temps que les premiers vertébrés il y a 500 millions
d'années (Lawlor et al. 1990). C'est un élément du système immunitaire des
vertébrés probablement sans équivalent chez les invertébrés. Les APM, le TCR et
plusieurs molécules auxiliaires de l'interaction APM-TCR sont membres de la
superfamille des immunoglobulines (Williams et Barclay 1988). Les molécules de
cette superfamille ont en commun une structure de base constituée d'un ou
plusieurs domaines d'immunoglobuline. Outre les immunoglobulines qui en
représentent probablement la forme la plus évoluée, plusieurs de ces molécules
ont des fonctions voisines ou complémentaires: fixation et présentation de
peptides (APM), reconnaissance d'un ligand (TCR), contact et/ou communication
entre cellules (CD3, CD4, CD8).
La
présence sur un même segment chromosomique de nombreux gènes des APM est le
résultat de leur longue évolution: ils sont dérivés par duplications répétées
et diversification d'un même gène ancestral. Il est possible que leur regroupement
favorise leur fonctionnement coordonné.
III – Structure et expression des gènes
et produits de classe I et II du CMH.
A – Structure des gènes et produits de classe I et II du CMH.
La molécule de Classe I est une glycoprotéine trans-membranaire
composée d'une chaîne lourde a
(44 kDa) associée de façon non covalente à une chaîne légère (11,5 kDa) non
glycosylée, la b2-microglobuline (b2m), qui n'est pas implantée dans la membrane
cellulaire. Le gène de classe I (= 3,5 Kb) comporte 8 exons et 7 introns. Les
exons 2, 3 et 4 codent les 3 domaines extra-membranaires a1, a2 et a3 de la chaîne lourde. Chaque domaine comporte
environ 90 ac. aminés. Certains sont stabilisés par un pont S-S. Un
oligosaccharide (CHO) de type complexe est lié à l'asparagine 86 du domaine a1. Les autres exons codent les régions
trans-membranaires (TM) et intra-cytoplasmiques (CYT). Le gène de la b2m (6,7 Kb) comporte 4 exons et 3 introns. La
majorité du domaine unique de la b2m
correspond au 2ème exon. Le gène de la b2m
est situé en dehors du CMH, sur le chromosome 15 chez l'homme.
La partie extra-cellulaire de la
molécule est symétrique avec deux domaines juxta-membranaires (a3 et b2m)
surmontés de deux domaines (a l et a 2) comportant chacun 4 replis b et une hélice a.
De l'extrémité N-terminale, la chaîne a
comporte 4 replis b anti-parallèles puis l'hélice a, à nouveau 4 replis b et une hélice a, puis le domaine a3, comportant 7 plis b anti-parallèles; un polypeptide de liaison de 13 résidus relie le
domaine a 3 à la région transmembranaire
(27 résidus) qui comporte probablement une hélice a permettant l'interaction des résidus hydrophiles
entre eux et la constitution d'une zone hydrophobe au contact de la double
couche lipidique. La région intra-cytoplasmique (28 résidus) interagit
probablement avec les phospholipides de la face interne de la membrane
cellulaire. Des connexions avec le cytosquelette sont possibles. Le domaine
constitué par la b2m comporte, comme le domaine a 3, 7 plis b
anti-parallèles solidarisés par un pont S-S. Le repli et l'assemblage de ces
domaines produisent une molécule dont la partie extra-membranaire s'inscrit
dans un cylindre de 7 nm de long et 4 à 5 nm de diamètre. Les domaines a 3 et b2m
forment une tige supportant les domaines a
l et a 2. Ceux-ci sont organisés en un
feuillet b, constitué par l'association des
8 replis b, supportant les deux hélices a. Ainsi se trouve formée un sillon de 2,5 x 1 nm,
identifiée au site de liaison du peptide. La cristallisation de la molécule
HLA-A2 a permis de visualiser au sein du sillon un matériel étranger à la
molécule, correspondant au peptide. C'est au niveau du sillon qu'est observée
la variabilité allotypique de la molécule.
Figure 2 : Structure tridimensionnelle des produits de classe I du CMH.
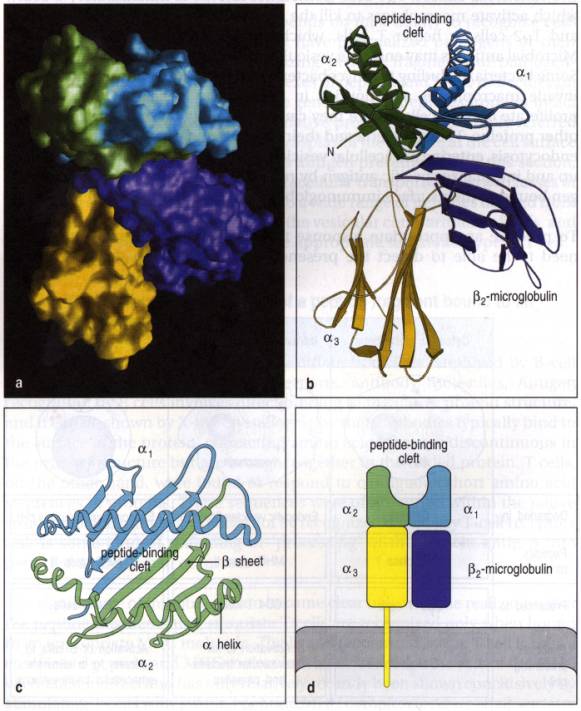
Photo :
Immunobiology, 1998, CA. Janeway. Ed Garland Publishing
B - Structure des gènes et produits de classe II du CMH.
La molécule de classe II est un hétérodimère composé d'une chaîne lourde a (32kDa) et d'une chaîne légère b (28 kDa). Chaque chaîne comporte deux domaines extra-membranaires. La différence de masse moléculaire des deux chaînes dépend de leur glycosylation: un oligosaccharide de type complexe sur la chaîne b, deux oligosaccharides (un complexe et un riche en mannose) sur la chaîne a. La taille des gènes de classe II varie de 7 à 18 Kb. Ils comportent 5 ou 6 exons. Les exons 2 et 3 correspondent aux 2 domaines extra-membranaires des chaînes polypeptidiques. Une chaîne invariante Ii (31 ou 33 kDa) fortement glycosylée s'associe aux chaînes a et b dans le réticulum endoplasmique, et s'en dissocie dans le compartiment endolysosomal. L'extrémité N-terminale de cette chaîne trans-membranaire est intra-cytoplasmique. Elle n'est pas exprimée à la membrane cellulaire. Le gène Ii (11,5 Kb) comporte 8 exons et 7 introns. Il est situé sur le chromosome 5 chez l'homme.
Figure 3 : Structure tridimensionnelle des produits de classe II du CMH.
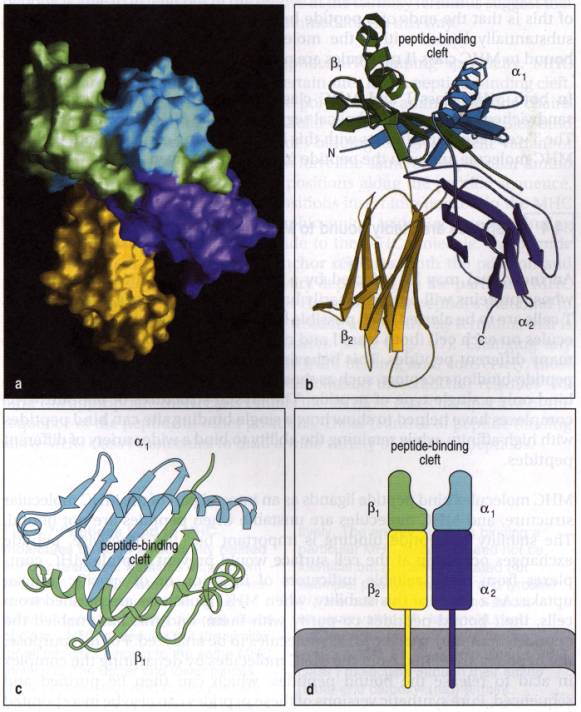
Photo :
Immunobiology, 1998, CA. Janeway. Ed Garland Publishing
C – Expression des
gènes et produits de classe I et II du CMH.
Bien que de structures très
semblables, les molécules CMH 1 et 2 se distinguent par leur distribution
tissulaire et leur spécialisation fonctionnelle (Tableau 1). Les molécules CMH
1 sont exprimées sur la majorité des cellules nucléées de l'organisme en
quantités très variables selon le type cellulaire et selon les conditions
physiologiques. L'expression est maximale sur les cellules lymphoïdes,
macrophagiques, dendritiques,
épithéliales et les endothéliales vasculaires. Les cellules du système
nerveux central n'expriment pas de molécules CMH 1. Elles sont très peu
nombreuses ou absentes des érythrocytes, des hépatocytes et des spermatozoïdes.
Elles sont bien exprimées sur les plaquettes sanguines. Des molécules CMH 1
solubles sont présentes dans les liquides biologiques et en particulier le
plasma sanguin. Il s'agit de molécules solubles sécrétées ou, plus souvent, de
produits de dégradation des glycoprotéines membranaires.
La
régulation d'expression des gènes de structure des molécules CMH 1 s'exerce au
niveau de la transcription puis au niveau de l'assemblage des chaînes et du
transport vers la membrane cellulaire. La régulation transcriptionnelle dépend
de plusieurs séquences de DNA ("promoter, enhancer, silencer")
situées en amont du premier exon du gène de structure. L'interaction de
diverses protéines avec ces séquences déclenche, augmente ou diminue la
transcription du gène. Certains facteurs régulateurs sont caractérisés. Une
augmentation d'expression peut être induite par I'IFN-g et le
TNF-a dont l'action est synergique. La chaîne a de la
molécule CMH 1 et la b2m sont synthétisées et assemblées dans le
reticulum endoplasmique (RE). A ce moment l'association d'un peptide contribue
à la stabilité de la molécule. Cette étape, ainsi que la glycosylation de la
chaîne a, a lieu en moins de 10 min. Le complexe a - b2m-peptide
traverse l'appareil de Golgi où la forme finale de glycosylation est acquise.
L'association de la b2m à la chaîne a est nécessaire à
l'expression à la membrane. La stabilité des molécules dépend de l'association a - b2m-peptide.
Elles sont mobiles dans la membrane. Leur pontage par des anticorps induit leur
rassemblement à un pôle de la cellule (" capping ") puis
leur endocytose. Les molécules HLA de la surface cellulaire sont constamment
remplacées par des molécules nouvellement synthétisées, de manière aléatoire,
indépendamment de leur âge (cinétique de premier ordre).
Les molécules HLA de classe II
constituent une famille d'hétérodimères de structure générale comparable à
celle des molécules de classe I qui comprend chez l'homme 4 molécules: lère DR,
2ème DR, DQ, DP sont exprimées, le plus souvent simultanément. La 2ème molécule
DR peut ne pas être codée par certains haplotypes (Figure 1). Des 4 molécules,
la 1ère DR est quantitativement la plus représentée. La molécule DQ peut ne pas
être exprimée sur une sous population de monocytes. Les molécules CMH 2 sont
exprimées constitutivement sur les lymphocytes B, les macrophages-monocytes,
les cellules dendritiques, les cellules épithéliales thymiques, les
endothéliums des vaisseaux capillaires et certains épithéliums des voies
digestives et respiratoires. Leur expression peut être induite par des
cytokines (IFN-g et TNF-a) dans de nombreuses cellules: lymphocytes T
(humains) lors de leur activation, cellules endocrines. Les chaînes a et b
des molécules CMH 2 sont synthétisées et assemblées dans le RE. Elles
s'associent alors à la chaîne invariante Ii pour former un trimère abIi. Des multimères (abIi )n sont possibles. La chaîne Ii porte des signaux de rétention dans
le RE, puis de transport à travers l'appareil de Golgi, vers les compartiments
endo-lysosomaux. La chaîne Ii est alors éliminée par protéolyse et le dimère ab s'associe à un peptide qui stabilise la molécule.
Celle-ci est transportée à la membrane cellulaire qui est atteinte 3 h après le
début de la synthèse.
La
glycosylation commencée dans le RE est achevée pendant la traversée du Golgi.
Le temps de renouvellement (tl/2) des molécules à la membrane est de 36 h. Une
partie des molécules est dégradée et/ou libérée dans le milieu. Leur
mobilisation à la membrane par des anticorps (capping) est moins aisée que
celle des molécules CMH 1. Dans certaines cellules elles peuvent être
internalisées et recyclées. Les dimères ab des diverses molécules
proviennent le plus souvent des produits des gènes voisins (en cis) d'un même
haplotype. Cependant la complémentation en trans est possible en particulier
pour les molécules DQ. Des hétérodimères inter-isotypiques, DRa-DQb ont
également été observés. La régulation de la transcription s'exerce au niveau de
plusieurs séquences en amont du gène de structure, et au niveau de séquences
introniques. Plusieurs facteurs se liant à ces séquences sont caractérisés
(Benoist et Mathis l990, Glimcher et Kara 1992). La transcription des divers
gènes de classe II est généralement coordonnée, cependant des dissociations
sont possibles. Chez la souris, 2 molécules de classe II, H-2A (I-A) et H-2E
(I-E) sont généralement exprimées. Dans certaines lignées, la molécule I-E
n'est pas exprimée, soit par défaut de transcription du gène Ea, soit
par anomalie du gène Eb. Ces animaux qui n'expriment qu'une molécule de
classe II (I-A) semblent immunologiquement normaux. Chez l'homme la non
expression de toutes les molécules CMH 2 induit un déficit immunitaire combiné
sévère. Elle est due à un défaut de transcription qui peut relever de plusieurs
anomalies distinctes des facteurs de transcription.
Tableau 1 : Comparaison des propriétés et caractéristiques des molécules CMH 1 et 2.
|
|
CMH 1
|
CMH 2
|
Expression
|
Sur la presque totalité des cellules nucléées
|
APC (a), lymphocytes B, certaines cellules activées
|
Lymphocyte T
|
100 000 mol./cell.
|
Non exprimé (b)
|
Lymphocyte B
|
260 000 mol./cell.
|
80 000 mol./cell. (c)
|
Temps de synthèse et d’expression (d)
|
1 heure
|
3 heures
|
Temps de renouvellement (t1/2) à la membrane cellulaire (e)
|
8-10 heures
|
36 heures
|
Peptides associés
|
8 à 9 résidus d’origine cytosolique
|
13 à 17 résidus d’origine extracellulaire ou membranaire.
|
Lymphocytes T reconnaissant le complexe CMH-peptide et conséquences
|
CD8+ cytotoxique. Lyse de la cible
|
CD4+ helper. Prolifération T, réponse cellulaire et coopération B.
|
(a) Antigen Presenting Cells: monocyte-macrophages, cellules dendritiques de la peau, des ganglions, du thymus. Epithélium thymique.
(b) Un petit nombre de lymphocytes T activés (5% des lymphocytes T circulants) expriment les molécules CMH 2.
(c) Les molécules DR sont plus nombreuses que les molécules DQ et DP.
(d) Temps écoulé entre la
synthèse dans le réticulum endoplasmique et l'expression à la membrane
cellulaire.
(e) Temps nécessaire au
remplacement de la moitié des molécules à la membrane par des molécules
nouvellement synthétisées. Une fraction des molécules peut être intemalisée et
recyclée.
IV – Variabilité et polymorphisme
Une variabilité et un polymorphisme élevés sont caractéristiques du CMH. Ils sont liés à la fonction présentatrice d'antigènes. La variabilité est définie par le nombre de nucléotides ou d'acides aminés différents entre deux gènes allèles et leurs produits. Le polymorphisme est défini au sein d'une population par le nombre et la fréquence des allèles à un locus.
La répartition des résidus variables et conservés dans les
domaines a1 et a2 des molécules de classe 1 est présentée dans la
Figure 3. La différence entre deux allèles peut aller de 1 à 30 résidus. La variabilité
est grande et essentiellement localisée au site fonctionnel de la molécule: le
sillon présentateur du peptide et la région de contact avec le TCR (hélices a). Une distribution comparable des résidus
variables est observée pour les molécules de classe II. Toutefois une partie du
site fonctionnel est invariable (DR a
1) ou peu variable (DQ a 1 et DP a 1). La variabilité est surtout concentrée au
niveau du domaine N-terminal de la chaîne b.
L'étendue
du polymorphisme actuellement observé dans la population humaine est indiquée
dans le Tableau 2. Initialement définis par les méthodes immunologiques, les
allèles sont maintenant caractérisés par leurs séquences. La correspondance
entre spécificités et allèles n'est pas parfaite. Dans de nombreux cas le
séquençage montre qu'une spécifïcité considérée comme homogène par le typage
sérologique regroupe plusieurs allèles. Ainsi la spécifïcité HLA-A2 correspond
à 13 variants alléliques (A2-01 à A2-13). Toutefois, bien qu'une seule
spécificité HLA-A2 soit définie dans un typage de routine, certains variants
peuvent être éventuellement distingués par un typage utilisant des immuns
sérums sélectionnés, ou par des techniques d'immunologie cellulaire. D'autre
part, les spécifîcités immunologiquement défînies peuvent être biologiquement
plus significatives que certains variants. En effet une variation située hors
du site fonctionnel de la molécule défmit un nouvel allèle biologiquement
neutre. A l'extrême, des mutations silencieuses peuvent définir de nouveaux allèles.
Une évaluation du polymorphisme est provisoire: de nouvelles spécificités et de
nouveaux allèles sont ajoutés périodiquement aux listes existantes lorsque de
nouvelles populations humaines sont explorées. La Nomenclature HLA 1994 (Bodmer
et al. 1994) reflète l'étude approfondie de populations caucasiennes. L'étude
des populations non caucasiennes, commencée au cours du 11ème International
Histocompatibility Workshop (Tsuji et al. 1992), suggère qu'à l'échelle de la
population du monde plus de 100 allèles pourraient être identifiés à certains
loci. En raison du nombre élevé d'allèles le taux d'hétérozygotie à chaque
locus est très élevé.
La structure du système HLA avec 3 séries multialléliques de classe I, et 4 séries de classe II (Tableau 2) permet le plus souvent l'expression de 14 molécules différentes à la membrane de certaines cellules d'un individu hétérozygote. La probabilité que deux individus non apparentés soient porteurs des mêmes allèles HLA est donc extrêmement faible, alors que dans une famille, en raison de la transmission en bloc (sauf recombinaison) des haplotypes HLA, deux germains ont une probabilité de 0,25 d'être HLA identiques. Cependant, l'étendue du polymorphisme dans la population est limité par l'observation d'association préférentielles entre certains allèles à des loci voisins. On dit qu'il existe un déséquilibre de liaison entre ces allèles. D'abord observé entre des paires d'allèles à des loci voisins (A-B, B-DR, DR-DQ), ce déséquilibre peut concerner des segments étendus d'haplotypes, conduisant à la notion d'haplotype conservé. Un exemple classique est l'haplotype HLA-A 1, B8, DR3, DQ2. La conséquence pratique de ce déséquilibre est l’augmentation de la fréquence observée d'un tel haplotype par rapport à la fréquence attendue (produit des fréquences des différents allèles). Un sujet porteur de cet haplotype aura une chance accrue de trouver un autre sujet porteur du même haplotype, ce qui peut être favorable dans la perspective d'une transplantation. L'origine de ce phénomène est hypothétique. Il pourrait être dû à une sélection naturelle s'exerçant sur une combinaison d'allèles conférant un avantage biologique. Il est beaucoup plus probable que les déséquilibres de liaison observés actuellement sont essentiellement liés aux migrations. Les haplotypes conservés correspondent aux haplotypes majoritaires de la population fondatrice.
Tableau 2 : Nombre de spécificités et d'allèles (polymorphisme) des séries HLA-A, B, Cw, DR, DQ, DP.
HLA-A HLA-B HLA-CW
Spécificités 1-4 51 8
Allèles identîfiés 50 97 34
HLA-DR(lère)
HLA-DR(2ème) HLA-DQ
HLA-DP
Spécificités 18 6 9 6
Allèles identifiés 106 14 26B, 15A 59B,8A
Le nombre d'allèles identifiés est celui figurant à la
Nomenclature HLA 1994 (Bodmer et al. 1994). La plupart des allèles sont
séquencés ou en train de l'être. Il n'y a pas de correspondance.terme à terme
entre spécificités et allèles car certaines spécificités (publiques)
correspondent à un épitope partagé par plusieurs allèles. Plus rarement,
certains allèles définis sérologiquement ne sont pas encore séquencés. La 1ère
série DR est constituée des produits DRB1, la 2ème série DR des produits
DRB3, DRB4 et DRB5. Pour les séries DQ et DP diverses associations des
allèles A et B génèrent un polymorphisme supplémentaire.
Figure
4 : Résidus variables des molécules HLA de classe I (à gauche) et de classe II
(à droite).
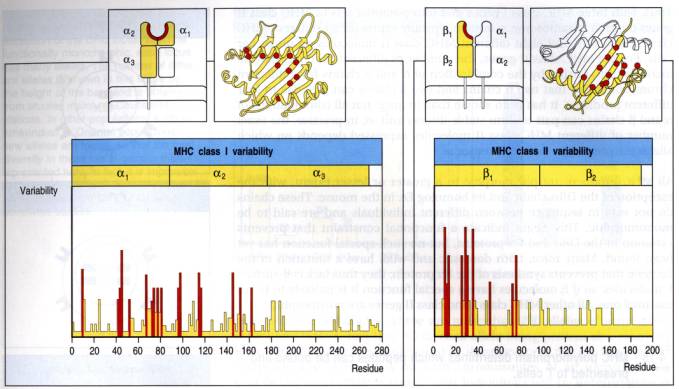
Photo :
Immunobiology, 1998, CA. Janeway. Ed Garland Publishing
Pour les molécules de classe I, La
variabilité est concentrée dans les domaines a1 (43,3% de résidus variables) et a2
(40,2%). Le domaine a3 est peu variable (17,49%) et le
domaine b2m complètement conservé. Dans les
domaines a1 et a2 la variabilité est principalement localisée au site
de liaison du peptide et des zones de contact avec le TCR.
Pour les molécules de classe II, la chaîne DR a est conservée. Comme dans la molécule CMH 1, le domaine juxta-membranaire (DRb2) est peu polymorphe. La variablilité est concentré sur le domaine DRb1. Une image comparable de la variabilité est observée pour les autres molécules CMH 2 à l'exception de la variabilité du domaine DQa1. Les fréquences de résidus variables sont respectivement 40,4% pour DRb1, 31,9% pour DQb1, et 20,7% pour DPb1; 0% pour DRa1, 26,4% pour DQa1 et 4,8% pour DPa1. Comme pour les molécules CMH 1, la variabilité est concentrée au niveau du site fonctionnel de la molécule CMH 2: site de liaison du peptide, zones de contact avec le TCR.
V – Présentation par les molécules de classe
I d’un peptide d’origine cytosolique au cours de la réponse immunitaire
cytotoxique.
Les
molécules CMH 1 participent à la réponse lymphocytaire T en présentant au TCR
un peptide dérivé d'une protéine synthétisée dans le cytosol de la cellule. Les
événements cellulaires qui conduisent à l’apprêtement d’un peptide endogène, à
sa combinaison avec une molécule de classe 1 du CMH puis à l’expression de ce
complexe CMH 1 -peptide à la surface de la cellule définissent la voie de
présentation endogène.
Figure 5 : Présentation
par les molécules de classe I d’un peptide d’origine cytosolique au cours de la
réponse immunitaire cytotoxique.
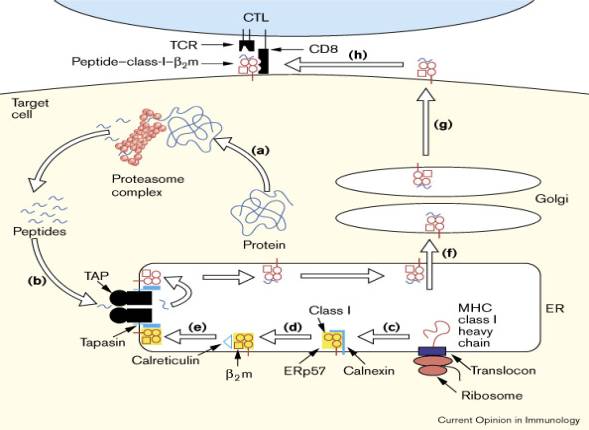
Les
molécules de classe I sont synthétisées dans le reticulum endoplasmique (RE).
Le pliage et l'assemblage de la molécule sont aidés par une protéine chaperon,
la calnexine. La chaîne a s'associe à la calnexine, puis le complexe a-b2m
s'associe à la sous-unité TAP 1 avant la liaison du peptide, enfin le complexe a-b2m-peptide
se dissocie de TAP. La protéine endogène est synthétisée principalement dans le
cytosol. Elle est le plus souvent dégradée en peptides par le protéasome, dont
au moins 2 éléments (LMP2 et LMP7) sont codés dans le CMH. Le transfert des
peptides dans le RE se fait par l'intermédiaire d'une pompe à peptide composée
de 2 éléments (TAP1 et TAP2) codés dans le CMH. Chaque élément comporte un
domaine C-terminal cytosolique ABC ("ATP Binding Cassette") et un
domaine N-terminal inséré dans la membrane du RE. TAP possède un site de
liaison et de reconnaissance des peptides, site auxquels contribuent les deux
sous-unités TAP 1 et 2. Certains peptides peuvent entrer dans le RE et
s'associer à la molécule CMH 1 directement ou après concentration par une
molécule chaperon. Des peptides dérivés du peptide signal de protéines
synthétisées dans le RE peuvent s'associer à la molécule CMH 1 (Henderson et
al. 1992, Wei & Cresswell 1992). Ils représentent environ 3% des peptides
présentés par CMH 1. Le complexe CMH 1 + peptide traverse les compartiments de
l'appareil de Golgi, puis gagne la membrane cellulaire dans une vésicule de
transport.
La formation du complexe chaîne a-peptide-b2m est nécessaire à l'expression et à la stabilité de la molécule CMH 1 à la membrane cellulaire. Bien que la majorité des peptides associés à CMH 1 soient d'origine cytosolique, d'autres peptides provenant du compartiment endolysosomal et de l'extérieur de la cellule peuvent aussi s' associer. Dans une cellule non infectée les peptides présentés proviennent de protéines autologues impliquées le plus souvent dans le métabolisme cellulaire.
Les peptides peuvent être élués des molécules CMH 1 et caractérisés (Rotzschke & Falk 1991). Ce sont presque toujours des nonamères de conformation étendue, enfouis dans le sillon de la molécule. Les résidus N- et C-terminaux sont associés par des liaisons hydrogène aux extrémités du sillon. Un ou deux des 9 résidus s'associent à des poches situées dans le sillon et constituent des points d'ancrage. L'étude des peptides associés à divers allotypes HLA et H-2 de classe 1 a permis de définir des motifs spécifiques d'allèle. Chaque allèle est cependant capable de lier plusieurs centaines de peptides différents, de sorte que la spécificité de la liaison est médiocre. Il semble que l'association CMH-peptide dans le RE soit rapide (de l'ordre de la minute) et que le complexe à la membrane cellulaire soit stable (plusieurs heures).
La présentation de peptides
endogènes par le CMH 1, et donc, par exemple, de peptides dérivés de virus
ayant infecté la cellules, est à l'origine de la description du phénomène de
restriction allogénique (Zinkemagel & Doherty 1974): les lymphocytes T
immuns reconnaissent à la fois un peptide d'origine virale et le CMH 1 de la
cellule cible. Si le peptide viral n'est pas présenté par le CMH autologue, il
n'est pas reconnu par les lymphocytes T cytotoxiques et la cellule infectée
n'est pas détruite. La reconnaissance spécifique du complexe CMH 1-peptide est
effectuée par le TCR d'un lymphocyte CD8+. La signalisation de l'événement de
reconnaissance par la molécule CD3 associée au TCR s'accompagne de l'activation
du lymphocyte T. Des molécules auxiliaires participent à l'interaction de la
cellule cible et de la cellule effectrice, en particulier la molécule CD8 qui
reconnaît un site spécifique du domaine a3
de la molécule CMH 1. D'autres molécules d'adhésion: CD2 et son ligand LFA-3,
LFA-1 et son ligand ICAM-1 contribuent à maintenir le contact entre la cellule
T et sa cible pendant les événements de reconnaissance et de lyse. Deux
mécanismes moléculaires non exclusifs peuvent conduire à la lyse de la cible:
-
l'apoptose
secondaire à un signal délivré par l'activation d'un récepteur membranaire et
conduisant à la fragmentation du noyau de la cellule cible
- la formation de trous dans la membrane sous l'action de la perforine libérée à partir de granulés du cytoplasme des lymphocytes cytotoxiques.
VI – Présentation par les molécules de
classe II d’un peptide d’origine extracellulaire aux lymphocytes T CD4+.
Les molécules CMH 2 présentent au
TCR essentiellement des peptides dérivés de protéines extra-cellulaires ou
membranaires introduites dans la cellule par la voie endosomale. L'origine
extra-cellulaire est démontrée dans de nombreux protocoles d'immunisation par
des protéines xénogéniques (Buus et al. 1987). Les lymphocytes T CD4+ prélevés
après l’immunisation ne prolifèrent in vitro en présence de la protéine
immunisante que si elle est prétraitée ou " apprêtée "
(" processing ") par les APC qui en extraient un peptide
reconnu par le TCR en association avec les molécules CMH 2. Les APC peuvent
être professionnelles, exprimant les molécules CMH 2 de façon constitutive, ou
occasionnelles: porteuses de molécules CMH 2 induites.
Les événements cellulaires qui
conduisent à l’apprêtement d’un peptide exogène, à sa combinaison avec une
molécule de classe 2 du CMH puis à l’expression de ce complexe CMH 2 -peptide à
la surface de la cellule définissent la voie de présentation exogène (Figure
6).
Figure 6 : Présentation par les molécules de classe II d’un peptide extracellulaire aux lymphocytes T CD4+.
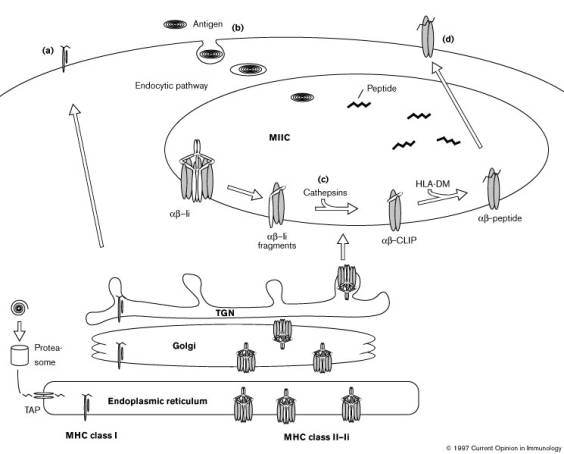
La voie
de présentation exogène est caractérisée par la rencontre dans le compartiment
de chargement du peptide (CCP) des molécules CMH 2 et de protéines exogènes.
Les chaînes a, b et Ii de classe II sont synthétisées et
assemblées, avec l'aide d'une protéine chaperone, dans le RE. Le trimère abIi [forme
(abIi)3 possible], est transporté à travers les compartiments
de l'appareil de Golgi vers un endosome précoce, puis vers le CCP. Le CCP est
distinct des endosomes et des lysosomes. Il est aussi appelé MIIC
("multilaminar class II compartment") ou CIIV ("class II
vesicle"). Il est caractérisé par la présence de CMH 2 classique, avec et
sans Ii, et de HLA-DM. Certaines molécules CMH 2 sont associées à CLIP
("class II associated invariant chain peptide"), qui devra être
éliminé lors du chargement du peptide. Les peptides dérivés des protéines
endocytosées par la cellule, présentes dans les endosomes, parviennent aussi
dans le CCP. Des protéines endogènes cytosoliques peuvent aussi être
transférées dans le CCP par un processus dépendant d'une protéine du choc
thermique de 70 kDa (Brodsky et Guagliardi 1991). Un gradient de pH (5 à 7)
permet la protéolyse et la dissociation de la chaîne Ii, et la protéolyse et
l'association des peptides (surtout) exogènes. La molécule HLA-DM (CMH 2 non
classique) contribue au chargement du peptide dans les molécules CMH 2 (Schmid
& Jackson 1994, Sanderson et al. 1994). Les molécules CMH 2 qui n'ont pas
chargé de peptide sont protéolysées dans les lysosomes bien que certaines
d'entre elles puissent parvenir jusqu'à la membrane.
A
la surface cellulaire, la majorité des molécules CMH 1 et CMH 2 est associée à un
peptide, mais quelques molécules "vides" sont probablement présentes.
Il est possible que certaines molécules CMH 1 et CMH 2 matures de la membrane
plasmique soient internalisées (via des puits revêtus de clathrine) et
recyclées vers la membrane après passage dans un compartiment endosomal ou
elles sont rechargées avec un nouveau peptide.
Un rôle majeur est joué par la chaîne invariante (Ii) dans les événements moléculaires conduisant à l'assemblage des chaînes ab et à l'expression à la membrane plasmique d'un complexe CMH 2-peptide. Le trimère abIi formé dans le RE ne peut pas lier de peptide. La présence de la chaîne Ii est responsable d'abord de la rétention du trimère dans le réticulum endoplasmique puis de son transport vers le compartiment endolysosomal. La chaîne Ii se sépare alors du dimère ab qui devient capable de fixer un peptide dérivé des protéines dégradées, dans le compartiment endolysosomal acide, par les enzymes appropriées.
Certaines
caractéristiques des peptides associés à la molécule CMH 2 les distinguent des
peptides liés à CMH 1. Ils comportent 12 à 25 résidus et les motifs spécifiques
d'allèles sont plus difficiles à définir. Le peptide s'associe au sillon de la
molécule CMH 2 par 2 ou 3 résidus d'ancrage dans sa partie centrale et seuls
les 9 résidus centraux sont effectivement insérés dans le sillon. Plusieurs
résidus N- et/ou C-terminaux du peptide sont situés à l'extérieur du sillon. Ce
modèle implique que le sillon CMH 2 est ouvert à ses extrémités alors que le
sillon CMH 1 est fermé. Il est possible que les conditions de liaison CMH
2-peptides soient moins contraignantes que celles des CMH 1 -peptides, que les
échanges de peptides soient plus faciles et qu'il existe un plus grand nombre
de molécules CMH 2 vides à la membrane cellulaire.
L'existence de deux classes de molécules (Tableau 1) et de deux voies de présentation correspond à un perfectionnement de fonction. Les molécules de classe II participent à la surveillance des fluides extra-cellulaires alors que les molécules de classe I contribuent au niveau de la membrane plasmique, au contrôle des protéines synthétisées par les cellules. Toutefois les deux voies ne sont pas strictement séparées, des peptides cytosoliques peuvent être présentés par des molécules CMH 2 et des peptides extra-cellulaires par des molécules CMH 1.
La reconnaissance par un lymphocyte T CD4+ d'un peptide présenté par une molécule du CMH 2, déclenche l'activation de ce lymphocyte. Tandis que le TCR reconnaît le peptide, la molécule CD4 reconnaît un site monomorphe au niveau du domaine b2 de la molécule CMH 2. Comme dans le cas de l'interaction CMH 1-peptide-TCD8+ décrit plus haut, des molécules auxiliaires (CD2/LFA-3, LFA-1/ICAM-1) contribuent au contact des cellules en présence. L'activation des cellules Th déclenche leur prolifération sous l'influence de facteurs solubles, en particulier l'interleukine-2 qui peut être sécrétée par les cellules T elles-mêmes (action autocrine). La coopération de lymphocytes Th et B conduit à la production d'anticorps. Les lymphocytes Th participent aussi à la prolifération et à la différenciation des cellules T cytotoxiques. Les cellules Th jouent un rôle central dans la réaction d'hypersensibilité retardée. C'est une réaction inflammatoire locale due principalement à l'infiltration des tissus par des macrophages activés. L'activation des macrophages est induite par les cytokines (en particulier IFN-g) produites par les cellules Th elles-mêmes activées
VII– Rôle du CMH dans la sélection
thymique des lymphocytes T et dans la génération du répertoire T.
Outre leur fonction de présentation de l'antigène au cours de la réponse immunitaire les molécules CMH ont un rôle majeur dans l’acquisition du répertoire des lymphocytes T. Les cellules pré-T d'origine médullaire se différencient en lymphocytes T dans le thymus au contact des molécules du CMH. Le thymus comporte une zone corticale avec des cellules épithéliales et une zone médullaire avec à la fois des cellules épithéliales et des cellules d'origine hématopoïétique. Toutes ces cellules expriment des molécules CMH 1 et 2 en quantité élevée. La maturation des cellules T se fait lors de la traversée du thymus de la corticale vers la médullaire. Au cours de ce transit, les cellules T se multiplient et génèrent par réarrangement aléatoire de leurs gènes un nombre élevé de TCR. Les cellules T sont alors sélectionnées en fonction de la spécificité de leur TCR (Tableau 3). Le CMH permet ainsi au système immunitaire de distinguer le soi du non-soi. Les lymphocytes T matures sont capables de reconnaître le CMH autologue présentant un peptide exogène (non-soi). En revanche, les lymphocytes T porteurs d'un TCR reconnaissant un auto-antigène (peptide du soi) présenté par le CMH autologue sont détruits dans le thymus.
Tableau 3 : Sélection thymique des cellules T en fonction de la spécificité de leur TcR.
Structure reconnue par le TCR Evénement
de sélection
Autre que CMH Non sélection
CMH non-soi Non sélection
CMH soi Sélection positive
a)CMH 1 soi Sélection des cellules CD8+
b)CMH 2 soi Sélection des cellules CD4+
CMH soi + peptide soi Sélection négative: élimination
Conservation
des cellules T capables de reconnaître le complexe CMH soi-peptide
non-soi=REPERTOIRE T
L'influence directe du CMH sur le
répertoire des lymphocytes T explique que le contrôle génétique de la réponse
immunitaire soit en partie sous la dépendance du CMH. Une réponse immunitaire
n'est en effet possible que si deux conditions sont remplies:
1) le peptide immunogène doit être présenté par le CMH autologue
2) le répertoire T doit comporter un TCR capable de reconnaître le complexe ainsi forrné.
Si l'une des conditions n'est pas remplie l'organisme est non répondeur à l’ antigène considéré. Une non-réponse humorale est généralement observée, puisque la majorité des réponses B nécessitent la coopération des lymphocytes T.
Afîn de permettre la réponse immunitaire la plus complète possible, le CMH doit être capable de présenter la collection de peptides la plus diverse possible. Cet objectif est atteint par la multiplication des molécules présentatrices (14 pour un humain hétérozygote) et par le développement du polymorphisme au niveau du site de présentation. La réponse allogénique quasi-constante en cas de greffe entre sujets non apparentés est ainsi la conséquence du polymorphisme nécessaire au bon fonctionnement du système immunitaire. Cette réponse est particulièrement intense en raison de l'expression quantitativement élevée des molécules du CMH sur de nombreux tissus.
L'incompatibilité HLA entre donneur et receveur constitue ainsi l'obstacle majeur à la greffe d'organe (rein, coeur, foie). L'efficacité de l'immunosuppression non spécifique permet le plus souvent de contrôler la réponse allogénique anti-HLA. Il est cependant démontré qu'une bonne compatibilité HLA diminue la fréquence des crises de rejet et contribue à une survie prolongée du greffon. En cas de greffe de moelle osseuse (source des cellules sanguines et immunitaires) l'idenfité HLA du donneur et du receveur est nécessaire, aussi le donneur est-il le plus souvent un germain HLA identique. Dans certains cas un donneur de moelle non apparenté peut être trouvé dans des fichiers de donneurs volontaires de groupe HLA connu.
VIII - CONCLUSION
La description immunogénétique classique du CMH est terminée. L'étude des structures moléculaires et de leurs fonctions est en cours. La caractérisation biochimique et structurelle des molécules impliquées dans la présentation et la reconnaissance du peptide doit conduire à la compréhension des mécanismes de la réponse lymphocytaire T. Les structures cristallographiques de 4 molécules CMH 1, d'une molécule CMH 2, de 2 complexes CMH l -peptides (Fremont et al. 1992, Matsumura et al. 1992) et d'un complexe CMH 2-peptide (Stem et al. 1994) sont connues. On attend avec intérêt la description structurelle du TCR et d'un complexe TCR-peptide-CMH. Des études fonctionnelles non encore achevées concernent le rôle des molécules du CMH dans l'éducation thymique des lymphocytes T et dans la constitution du répertoire T, dans l'activation et les fonctions effectrices des cellules T. De nombreux mécanismes moléculaires restent à préciser, en particulier le rôle des molécules dites auxiliaires, des médiateurs intra- et extra-cellulaires et de leurs récepteurs. Ces recherches devraient progresser rapidement en raison de l'efficacité des outils technologiques de la biologie moléculaire. Il est en effet possible de modifier à volonté les molécules étudiées, d'obtenir des cellules et des animaux porteurs ou dépourvus de ces molécules. Les études fonctionnelles comparatives sont alors faites avec les cellules et animaux normaux et modifiés. Un autre domaine fondamental de recherche concerne la régulation d'expression des produits du CMH.
L'étude fondamentale du CMH est particulièrement intéressante puisque l'on s'achemine vers l'identification des 100 à 200 gènes de la région. Ces 4 Mb de DNA seront peut-être le premier segment du génome complètement exploré au niveau de la structure du DNA et du fonctionnement des gènes qui s'y trouvent.
REFERENCES
1 - Benoist C, Mathis D. (1990)
Regulation of major histocompatibility complex class-Il genes: X, Y, and other
letters of the alphabet. Annu.
Rev. Immunol., 8, 681-716.
2
- Bjorkman PJ, Saper MA, Samraoui B, Bennett WS, Strominger JL, Wiley DC. (1987)
Structure of the human class I histocompatibility antigen HLA-A2. Nature, 329,
506-511.
3 - Bjorkman PJ, Saper MA,
Samraoui B, Bennett WS, Strominger JL, Wiley DC. (1987) The foreign antigen
binding site and T cell recognition regions of class I histocompatibility
antigens. Nature, 329, 512-518.
4 - JG Bodmer, SGE Marsh, ED
Albert et al. (1994) Nomenclature for factors of the HLA system, 1994. Hum Immunol, 41, 1-20.
5
- Brodsky FM, Guagliardi LE. (1991) The cell biology of antigen
processing and presentation. Annu. Rev. Immunol., 9, 707-744.
6
- Brown JH, Jardetzdy T, Saper MA, Samraoui B, Bjorkman PJ, Wiley DC. (1988)
A hvpothetical model of the foreign antigen binding site of class Il
histocompatibility molecules. Nature, 332, 845-849.
7 - Brown JH, Jardetzkty TS, Gorga
JC, Stem LJ, Urban RG, Strominger JL, Wiley DC. (1993) Thrce dimensional
structure of the human class II histocompatibility antigen HLA-DRI. Nature,
36.4, 333-9.
8 - Buus S, Sette A, Grey HM.
(1987) The interaction between protein derived immunogenic peptides and Ia.
Immunol. Rev., 98, 115-142.
9 - Chothia C, Boswell DR, Lesk-
AM. (l988) The outline structure of the T-cell a-b reoeptor. Embo J., 7,
3745-3756.
10 - Trowsdale J, Ragoussis J,
Campbell RD. (1991) Map of the human major histocompatibility complex. Immunol.
Today, 12,443-444.
11 - Tsuji K, Aizawa M, Sasazuki T
(ed). (1992) HLA 1991, Proceedings of the 11th Intemational Histocompatibility
Workshop and Conference. Oxford University Press, 1992.
12 - Wei ML, Cresswell P. (1992)
HLA-A2 molecules in an antigen-processing mutant cell contain signal
sequence-derived peptides. Nature, 356, 443-446.
13 - Williams AF, Barclay AN.
(1988) The immunoglobulin superfarnily domains for cell surface recognition. Annu. Rev. Immunol., 6,381-406.
14
- Zinkemagel RM, Doherty PC. (1974) Restriction of in vitro T
cell-mediated cytotoxicity in lymphocytic choriomeningitis within a syngeneic
or semiallogeneic system. Nature, 248, 701-702.