Chapitre 23
Greffes et Transplantations
I – lntroduction
A— Généralités
Depuis
la première transplantation rénale en 1956, les transplantations d'organes ont bénéficié
de progrès remarquables dans les techniques chirurgicales, les connaissances
des systèmes d'histocompatibilité et les traitements immunosuppresseurs. Les
indications des transplantations se sont peu à peu précisées, de sorte que ce
traitement est aujourd'hui couramment pratiqué en cas de défaillance
irréversible d'un organe ou d'un tissu. A titre d'exemple, on pratique chaque
année en France près de 2000 transplantations de rein, 600 transplantations de
cœur, 500 transplantations de foie et près de 800 greffes de moelle osseuse.
Les durées de survie du transplant se sont remarquablement accrues à moyen
terme : 90% à 1 ans, et 70% à 5 ans pour les transplantations rénales et
cardiaques, mais l'évolution à long terme (10 à 20 ans) pose encore de nombreux
problèmes non résolus.
B— Définitions
Le
terme transplantation désigne le prélèvement d'un organe sur un donneur
et son implantation chez un receveur avec rétablissement de la continuité
vasculaire (Ex : cœur, poumon, foie, rein).
Le
terme greffe est utilisé pour des tissus lorsqu'il n'y a pas
d'anastomose vasculaire (greffe de moelle, greffe de cornée).
On
parle d'autogreffe lorsque le donneur et le receveur sont le même
individu, de greffe syngénique lorsqu'il sont génétiquement identiques
(jumeaux monozygotes), d'allogreffe lorsqu'il sont génétiquement
différents mais de la même espèce et enfin de xénogreffe lorsqu'ils
appartiennent à des espèces différentes.
La
transplantation est orthotopique si l'organe est implanté chez le
receveur dans la position anatomique qu'il occupait chez le donneur. Dans le
cas contraire, il s'agit d'une transplantation hétérotopique.
Figure
1 :
La réaction de rejet est contrôlée par la relation génétique entre le donneur
et le receveur.
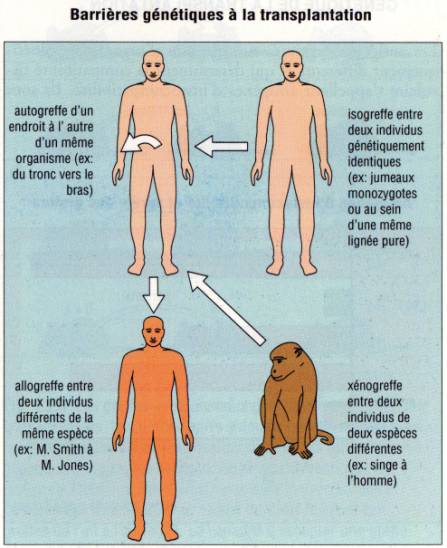
Figure :
Immunologie, I. Roitt, 1994 , DeBoeck Université
Le devenir du transplant dépend essentiellement de
la réaction immunologique du receveur vis-à-vis d'antigènes de transplantation
propres du donneur et portés par le greffon. Parmi les substances antigéniques faisant
l'objet d'un polymorphisme au sein de l'espèce, la transplantation a permis
d'identifier un ensemble d'antigènes tissulaires codés par des gènes alléliques
définissant des systèmes d'histocompatibilité :
- Les
groupes sanguins ABO et Lewis
- Le complexe
majeur d'histocompatibilité codant les molécules de classe I et II du CMH
- Les
antigènes mineures d'histocompatibilité codant des superantigènes (MLS)
La réaction immunologique du receveur dirigée
contre les antigènes portés par le greffon met enjeu
- des cellules T
- des
Ac
La réaction immunologique va induire des lésions
tissulaires et des perturbations des fonctions biologiques du transplant
décrites sous le nom de réaction de rejet. Le rejet peut
être suraigu, aigu ou chronique. Lorsque le
receveur est incapable de rejeter un greffon allogénique, à la suite d'un
déficit immunitaire pathologique ou thérapeutique, et si ce greffon contient
des lymphocytes T, ces derniers peuvent reconnaître les Antigènes du receveur
et induire une réaction du greffon contre l'hôte (GVH : Graft versus host
reaction).
II – Aspects
cliniques de la transplantation
A — Donneur
II existe deux types de donneurs
Donneurs vivants
Moelle osseuse, rein
Donneurs en état de mort cérébrale
Tous les autres prélèvements.
Chaque donneur fait l'objet d'un typage ABO,
Rhésus, HLA-A, B, DR ainsi que des examens destinés à éviter la transmission
d'infections : HBV, HCV, HIV, HTLV, CMV.
Les
règles de sélection du receveur sont un compromis entre
- Les
facteurs immunologiques
- Le
caractère plus ou moins urgent de la transplantation
- Le
délai de conservation de l'organe
Les
transplantations d'organes sont toujours faites en compatibilité ABO. On évite
ainsi les lésions du greffon dues aux anticorps naturels anti-A et anti-B. On
réalise un cross-match lymphocytaire destiné à rechercher la présence d'Ac
anti-HLA dirigés contre les antigènes du greffon et produits par le receveur
après grossesse, transfusion sanguine ou greffe. Un cross-match positif est une
contre indication à la transplantation d'organe.
Bien
que le pourcentage de survie du greffon à long terme augmente légèrement en
fonction du nombre d'identités HLA-A, B, DR entre donneur et receveur, les incompatibilités
au niveau des produits de ces locus ne sont jamais une contre indication à la
transplantation d'organe. Les greffes de moelle osseuse sont le plus souvent
pratiquées entre frère et sœur génotypiquement HLA identiques, sans tenir
compte des groupes sanguins ABO. 0n peut utiliser des donneurs semi-identiques
et surtout des volontaires non apparenté phénotypiquement identique ou très
proches du receveur, avec identité des gènes de classe II et si possible une
réaction lymphocytaire mixte faible ou nulle.
Figure 2 :
Cross-match lymphocytaire.
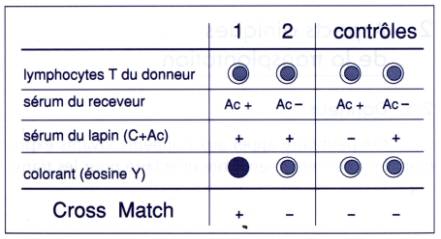
Figure :
Immunologie, JP. Revillard, 1994 , DeBoeck Université
B — Conditionnement du greffon
Les organes sont débarrassés du sang qu'ils
contiennent par lavage à 40°C avec une solution tamponnée de composition proche
de celle du milieu intracellulaire. Les organes peuvent alors être conservés
quelques heures (4 à 6 heures pour le foie et le cœur, 30 heures pour le rein).
Les suspensions de cellules hématopoïetiques
destinées aux greffes de moelle peuvent faire l'objet d'un conditionnement
particulier : Elimination ou séparation de différents types cellulaire grâce à
des Ac monoclonaux par exemple. Ces méthodes sont utilisées pour éliminer des
cellules tumorales dans les autogreffes de moelle et pour diminuer la
contamination en lymphocytes T matures dans les allogreffes. Les allogreffes de
moelle appauvrie en cellules T matures induisent moins de réaction de greffon
contre l'hôte mais semblent être moins efficaces pour la prévention des
rechutes de leucémies.
C — Devenir du greffon chez le receveur : Rejet et GVH
1 — Greffe de cellules souches
hématopoïétiques
Autogreffes de moelle
osseuse
S'adressent
à des malades atteints de différentes formes de cancers métastatiques ou de myélomes
résistants aux autres traitements. On réalise un prélèvement de moelle osseuse
qui sera congelé après élimination des cellules tumorales. Le malade est alors
traité par radiothérapie/chimiothérapie à dose léthale ou supraléthale puis on
lui re-injecte sa propre moelle. Le délai de reconstitution hématopoïétique est
comparable à celui d'une allogreffe mais il n'y a évidemment pas de réaction du
greffon contre l'hôte.
Allogreffes
Dans
l'immense majorité des cas, les allogreffes de moelle osseuse sont réalisées
chez des malades atteints de leucémies aiguës ou chroniques chez des sujets
âgés de moins de 50 ans en première rémission. Ces malades sont soumis à un
protocole d'immunosuppression
majeure associant irradiation totale et chimiothérapie immédiatement avant la
greffe. La reconstitution hématopoïétique puis immunologique est progressive.
Elle peut être accélérée par administration de facteurs de croissance. Le
déficit en anticorps est corrigé par un traitement substitutif par lgIV.
Les principales complications de ces greffes sont
la survenue de réaction du greffon contre l'hôte, d'infection et de tumeurs. La
réaction aiguë du greffon contre l'hôte se caractérise par de la fièvre, des
manifestations cutanées (érythrodermie), une hépatite cholestatique (ictère) et
des lésions intestinales (diarrhées). A l'examen, on note une splénomégalie et
des adénopathies. Ces formes aiguës sont en général réversibles après
administration d' immunosuppresseurs.
Les
GVH chroniques induisent des signes cutanés, hématologiques et des
manifestations auto-immunes par activation polyclonale des lymphocytes B.
Les
infections sont des infections opportunistes à virus du groupe de l'herpès, des
bactéries encapsulées ou des protozoaires. Des lymphomes B souvent associés au
virus d'Epstein-Barr peuvent apparaître sous immunosuppression intensive ou
dans le cadre d'une GVH chronique.
Figure
3 :
Méthode de conditionnement du receveur avant greffe de moelle.
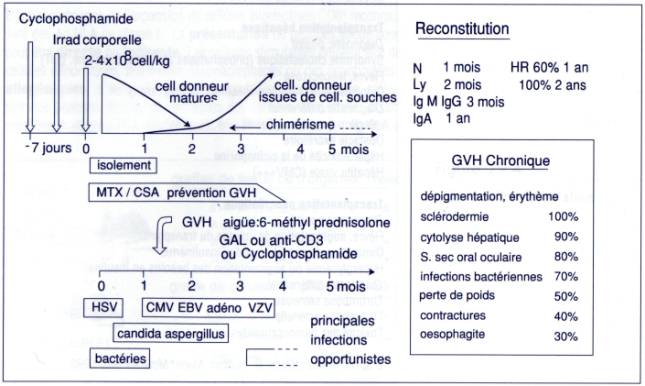
Figure :
Immunologie, JP. Revillard, 1994 , DeBoeck Université
2 — Autres greffes de tissus
Les greffes de cornée
Relativement
bien tolérées, elle peuvent néanmoins donner lieu à des réactions de rejet avec
kératites et opacification par infiltration cellulaire de l'endothélium. Elles ne
nécessitent qu'un traitement corticoïde local par collyre.
Les greffes de peau allogéniques
Le
rejet se caractérise par un épaississement et une induration au jours 7 par
infiltration peri-vasculaire du derme par des cellules mononucléées puis d'une
nécrose au jour 10 suivie de l'élimination du greffon. Elles sont surtout
utilisées pour aider la cicatrisation des brûlures étendues grâce à leur apport
de facteurs trophiques pour Pépidermisation. En cas de brûlure peu étendue, on
peut réaliser des greffes autologues qui ne sont pas rejetées. Dans aucun de
ces deux cas on administre de traitement immunosuppresseur.
Les greffes d’os humain et les greffes valvulaires de porc
Elles
ne donnent pas lieu à un rejet immunologique car elle ne comportent pas de tissu
immunogénique : Le tissu vivant de l'os (ostéoclastes, ostéoblastes, vaisseaux,
moelle) est détruit et seule la matrice protéino-calcique est utilisée. Les
valvules cardiaques de porc sont traitées par des agents qui détruisent les
cellules et dénaturent les protéines de surface immunogènes. Ces tissus n'étant
pas immunogéniques, aucun traitement immunosuppresseur n'est administré.
3 — Principales indications des greffes
de tissus
Allogreffes de cornées
- Cornées non inflammatoires
(90 % des cas, 90-95 % succès)
. œdème cornéen
(pseudophaque)
. malformation
(kératocône)
. séquelles traumatiques
. séquelles infectieuses
(herpès)
- Cornées
hypervascularisées (10 % des cas, 50 % de succès)
amélioration par : greffons
HLA compatibles, traitement immunosuppresseu
- Urgence en cas de
perforation de la cornée
Allogreffes cutanées
Grands brûlés (surface
> 50 %, 3' degré)
Couverture transitoire par
allogreffe :
. permet la survie
. rejet après 10-20 jours
. remplacement par
autogreffe, allogreffe en culture
ou sandwich d'autogreffe à
large maille avec allogreffe
Allogreffes osseuses
- Pertes de substances
segmentaires :
. résection de tumeurs
malignes osseuses
. traumatismes majeurs
. changement de prothèses
avec dégâts majeurs
- Comblements de cavités :
. tumeurs bénignes
. reconstruction du cotyle
pour arthroplastie
. traumatismes
épiphysaires
. comblement pour fusion
en compression (dèses, ostéotomies)
Allogreffes vasculaires
- Allogreffes artérielles (aorto-iliaques
ou distales) :
. infection de prothèses
vasculaires (aorte : mortalité diminuée de 40 à 13%)
. revascularisation
distaie (ischémie sous-poplitée) en l'absence de veine
autologue
- Allogreffes veineuses
(stripping) :
. revascularisation distale
(ischémie sous-poplitée) en l'absence de veine
autologue
. accès vasculaire pour
hémodialyse (fistules artério-veineuses)
. maladie de Lapeyronie
Allogreffes valvulaires cardiaques
- Avantages par rapport
aux valves mécaniques ou aux xénogreffes :
. meilleure performance
hémodynamique, absence d'hémolyse
. absence de traitement
anticoagulant prolongé
. meilleure résistance à
l'infection
. longévité supérieure à
celle des xénogreffes
- Indications privilégiées
:
. infection valvulaire
(Osier)
. remplacement de prothèse
infectée
. enfant (traitement
anticoagulant mal toléré)
4 — Le rejet allogénique
Contrairement à un certain nombre de greffes
tissulaires, toutes les transplantations d'organes allogéniques sont soumis à
un traitement immunosuppresseur, maintenu tant que le transplant demeure
fonctionnel. Les doses d'immunosuppresseur seront progressivement diminuées au
cours du temps (phénomène d'adaptation du greffon) mais jamais interrompus.
Le rejet suraigu
II
est exceptionnellement observé. Il est dû à la présence d'Ac d'alloimmunisation
anti-HLA chez le receveur. Il se manifeste dans les minutes qui suivent le
rétablissement de la continuité vasculaire par un infarctus du transplant. L'un
des mécanismes de ces rejets suraigus est la fixation sur l'endothélium
vasculaire d'Ac d'allo-immunisation anti-HLA chez le receveur. Ces rejets sont
évités par la pratique systématique du cross-match lymphocytaire. Des rejets
suraigus peuvent néanmoins survenir en l'absence d'Ac préformés détectés par le
cross-match lymphocytaire.
Le rejet aigu
II survient à partir du 4éme jours après la
greffe et se traduit par des signes généraux (fièvre, malaise), des signes
fonctionnels ou biologiques qui dépendent de l'organe transplanté :
hypertension artérielle, oligourie, élévation de lacréatinine dans le cas d'une
greffe de rein.
Le mécanisme essentiel est une infiltration du
greffon par les cellules T du receveur avec réaction immunitaire à médiation
cellulaire. La biopsie du transplant montre l'infiltration péri-vasculaire de cellules mononucléées.
On observe en outre une augmentation des antigènes de
classe II du CMH sur l'endothélium du greffon consécutive à la production
locale de cytokines (IFN-g). Les crises de rejet aigu constituent
une urgence médicale. Leur réversibilité dépend de la précocité de leur
traitement.
Le rejet chronique
II
se traduit par la détérioration lente, progressive et irréversible du greffon.
Les lésions histologiques associent une fibrose péri-vasculaire et
interstitielle et des lésions vasculaires.
Figure
4 :
Diagnostic du rejet aigu en transplantation d’organe.

Figure :
Immunologie, JP. Revillard, 1994 , DeBoeck Université
III – Immunologie du
rejet d’allogreffe
A — Modèles animaux : lois de la transplantation
L'utilisation de lignée de souris consanguines,
homozygotes au niveau du CMH, a permis de réaliser des observations connues
sous le nom de lois de la transplantation, qui s'appliquent aux animaux non traités
par des immunosuppresseurs.
1 — Transplantation d’organe ou de tissu
Les greffes entre deux souris d'une même lignée
(ayant le même CMH) n'induisent pas de rejet.
Les
greffes entre deux lignées incompatibles au niveau de leur CMH induisent un rejet
aigu constant en 8 à 10 jours. Une deuxième greffe du même donneur est rejeté
de façon accélérée (5 à 6 jours) ce qui traduit l'induction d'une mémoire
immunitaire spécifique des Ag du CMH du donneur.
Les
greffes de chaque lignée parentale a un hybride FI de première génération sont
acceptées, alors que les greffes d'un organe provenant de l'hybride aux parents
sont rejetées. Ce phénomène correspond au fait que l'expression des produits du
CMH des deux haplotypes a et b de l'hybride est codominante ; chaque cellule de
l'organisme expriment les Ag des deux lignées parentales.
Le
rejet est dû aux lymphocytes T. Il n'apparaît pas chez les souris athymiques.
Figure 5 : Loi de la transplantation
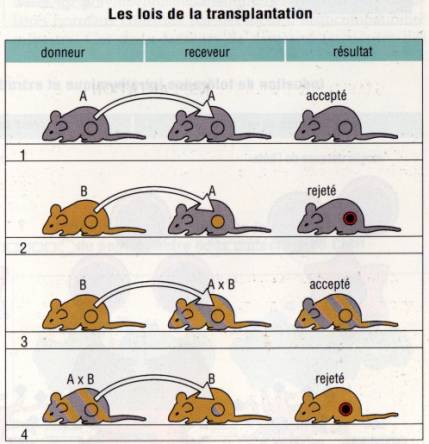
Figure :
Immunologie, I. Roitt, 1994 , DeBoeck Université
2 — Greffe de moelle
L'injection
de moelle osseuse ou de cellules lymphoïdes T matures (cellules spléniques) de
A à B est rejetée.
Si le receveur est un souriceau nouveau-né dont le système
immunitaire n'est pas encore mature, il se produit une réaction du greffon
contre l'hôte.
L'injection
de cellules lymphoïdes d'une lignée parentale A ou B à un hybride F1(AxB)
induit de même une GVH car l'organisme de l'hybride est génétiquement incapable
de rejeter les cellules T du greffon.
Des phénomènes analogues sont observés lors de la
reconstitution d'un receveur, irradié à dose léthale, à l'aide de cellules
médullaires d'un donneur histo-incompatible au niveau du CMH.
Si
le greffon contient à la fois des cellules T CD4+ et CD8+ on observe une GVH
aiguë. S'il contient seulement des cellules CD8+ ou CD4+, ou bien si
l'histoincompatibilité ne concerne que les gènes de classe I ou de classe II du
CMH, cette GVH peut être prolongée.
L'injection
de cellules souches hématopoïetique d'une souris A à des souriceaux nouveau-né
B, est susceptible d'induire un microchimérisme accompagné d'une tolérance
vis-à-vis des greffes de tissu du donneur A, malgré l'immunocompétance
démontrée par le rejet dans des délais normaux d'une greffe d'une autre lignée
C.
Des
expérience analogues ont été réalisées chez l'adulte par injection de cellules
de moelle osseuse d'un donneur A à un receveur allogénique traité par
irradiation lymphoïde totale ou par administration d'anticorps
anti-lymphocytaires. Dans ces expériences, la tolérance existe tant que
persiste le chimérisme lymphoïde.
Figure 6 : Réaction du greffon contre l’hôte
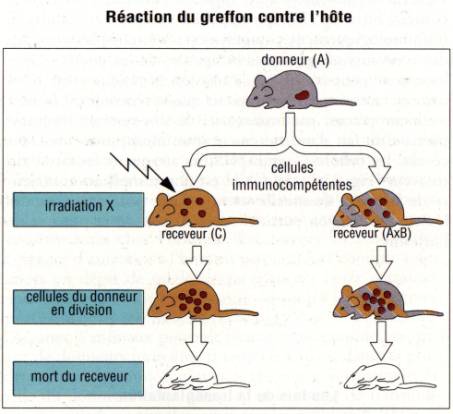
Figure :
Immunologie, I. Roitt, 1994 , DeBoeck Université
B — Modèles in vitro de la réaction d’allogreffe
La réaction lymphocytaire mixte comporte
l’activation, la transformation et l'expansion clonale des cellules T
alloréactives CD4+ spécifiques de l'un des antigènes HLA de classe II des
cellules stimulantes. Elle s'accompagne de l'expansion des cellules
alloréactives CD8+ reconnaissant des Ag HLA de classe I.
Le
rôle relatif des sous populations de cellules T dans la réaction de rejet peut
être étudié chez des animaux athymiques. L'injection de cellules CD4+ chez des
souris athymiques entraîne le rejet aigu des allogreffes de peau. Les
lymphocytes T CD8+ naïfs provenant d'un donneur non sensibilisé, n'ont pas cet
effet, sauf si ils sont mélangés avec un petit nombre de cellules T CD4+.
L'importance des CD4+ peut être démontrée par
l'injection d'Ac anti-CD4 conduisant à la prolongation de la survie du greffon.
Figure
7 :
Rôle des différentes sous-populations lymphocytaires T dans la reaction de
rejet d’allogreffe.
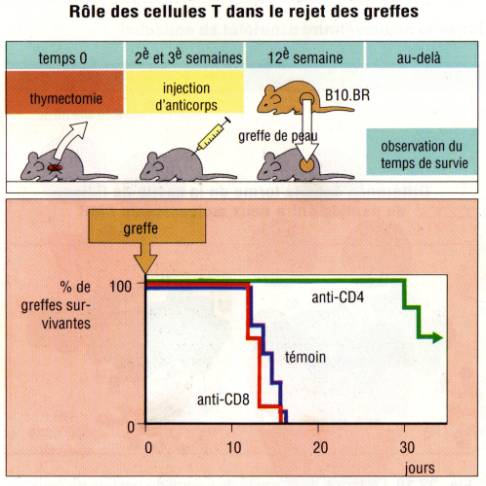
Figure :
Immunologie, I. Roitt, 1994 , DeBoeck Université
C — Reconnaissance directe et indirecte.
Les
lymphocytes T CD4+ sont activés par les CPA exprimant les molécules de classe
II du CMH. Les CPA impliquées dans le rejet allogénique sont essentiellement
celles du donneur. Les cellules dendritiques provoquent l’activation directe
des lymphocytes T du receveur. Au cours de leur différenciation dans le thymus,
les lymphocytes T ont acquis la propriété de reconnaître, via leur récepteur
pour l’antigène (TcR), des complexes formés de peptides étrangers liés à des
molécules de CMH autologues. Cette « restriction allogénique » de la
reconnaissance semble donc être antinomique d’une reconnaissance directe entre
le TcR d’un lymphocyte T du receveur et un complexe peptide-CMH allogénique
présent à la surface de la CPA du donneur. En fait, au cours de la réponse
directe, le TcR du lymphocyte T du receveur ne réagit pas contre le complexe
peptide-CMH allogénique présent à la surface de la CPA du donneur mais contre
l’un des constituant du complexe pris individuellement. Ainsi, au cours de la
réponse directe, deux types d’interactions peuvent avoir lieu entre le lymphocyte T du receveur et la
CPA du donneur. D’une part, si le peptide fixé sur la molécule de CMH allogénique
présente une très forte affinité pour le TcR d’un lymphocyte T du receveur,
cette interaction peut être suffisante pour activer le lymphocyte T. Une telle
propriété ne peut avoir lieu dans le contexte du CMH du soi puisque les
complexes CMH-peptide de très forte affinités ont été éliminés au cours de la
sélection négative thymique. Toutefois, deux molécules de CHM distinctes
présentent un spectre de peptides
très différents ce qui explique que certains peptides complexé aux molécules de
CMH allogéniques et présentés à la surface de la CPA du donneur puissent
activer directement certains lymphocytes T du receveur. Ce type de
reconnaissance directe est appelé reconnaissance directe peptide-dépendante.
Alternativement, mais de façon moins fréquente, il existe une reconnaissance
directe appelée CMH-dominante dans laquelle le TcR de certains lymphocyte T du
receveur reconnaissent des régions conservées présente sur la molécule de CMH
allogénique. Dans ce cas l’activation du lymphocyte T est indépendante du
peptide fixé sur les molécules de CMH allogéniques et dépend de la densité des
molécules de CMH allogéniques présentent à la surface des CPA du donneur.
L’action conjointe de ces deux mécanismes de reconnaissance directe explique la
grande fréquence des lymphocytes T allogéniques présents chez un individu (1 à
10% de l’ensemble des lymphocytes T)
et explique la violence de la réaction de rejet de greffe allogénique
Les
CPA du receveur peuvent aussi capter des Ag provenant du greffon et les
présenter par les molécules de classe II autologues aux lymphocytes T
spécifiques. Cette voie de présentation est appelée voie de présentation indirecte.
L'activation directe stimule davantage la réaction
de rejet que la voie indirecte. Quelle que soit la voie d'activation, les
lymphocytes ainsi activés vont produire des cytokines nécessaires à la
prolifération et à la différentiation d'autres cellules engagées dans la
réaction de rejet.
Figure 8 : Mécanisme cellulaire de la reconnaissance directe
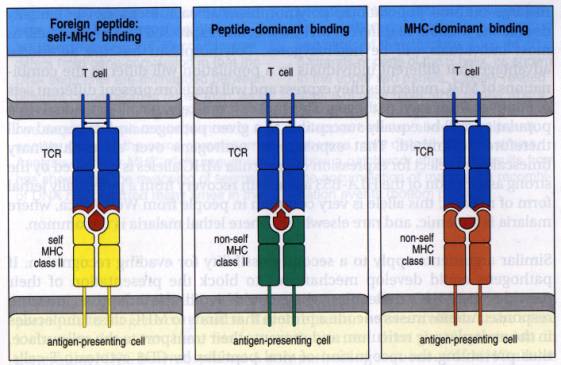
Figure : Immunobiology, CA. Janeway, 1998 , Garland Publishing
Figure 9 : Reconnaissance directe et reconnaissance indirecte

Figure : Immunobiology, CA. Janeway, 1998 , Garland Publishing
D — Mécanismes effecteurs de la réaction de rejet.
Trois mécanismes interviennent dans la génération des
lésions du greffon : la production de cytokines, les cellules T alloréactives
et les anticorps. Au cours du rejet aigu, les cellules CD4+ alloréactives
stimulées par les Ag HLA de classe II portés par l’endothélium du greffon et
les cellules dendritiques produisent un grand nombre de cytokines (IL-2, IFN-g et TNF-a)
qui stimulent la production d'IL-1, d'IL-6, d'IL-8 et l'expression des
molécules de classe II par les cellules endothéliales, augmentent la
perméabilité vasculaire et provoquent l'infiltration caractéristique par les
cellules mononucléées et, à plus long terme, la prolifération endothéliale. Les
taux de TNF, d'IL-6 et de CRP sont augmentés dans le sérum. Ces lymphokines
sont produites principalement par les cellules T CD4+ de type Th1. Les cellules
Th2 produisent de l’IL-4 et de l’IL-10 qui diminuent la réponse à médiation
cellulaire mais augmentent la synthèse d'allo-anticorps.
Les cellules T cytotoxiques détruisent les cellules
du greffon par reconnaissance des HLA de classe I, adhérence et synthèse de
perforine conduisant à la lyse de la cellule cible. En plus des cellules T
cytotoxiques CD8+, les cellules NK stimulées par les cytokines participent
aussi à la lyse du tissu cible. Au cours de l'exceptionnel rejet suraigu, les
alloanticorps se fixent sur les Ag du greffon portés par l’endothélium
vasculaire. Ils activent le système du complément et provoquent une réaction de
rejet suraigu avec accumulation de plaquettes et de polynucléaires
neutrophiles. A un taux plus faible, ces Ac contribuent avec les lymphocytes T
à la formation des lésions vasculaires du greffon.
Figure 10 : Mécanismes effecteurs de la réaction de
rejet
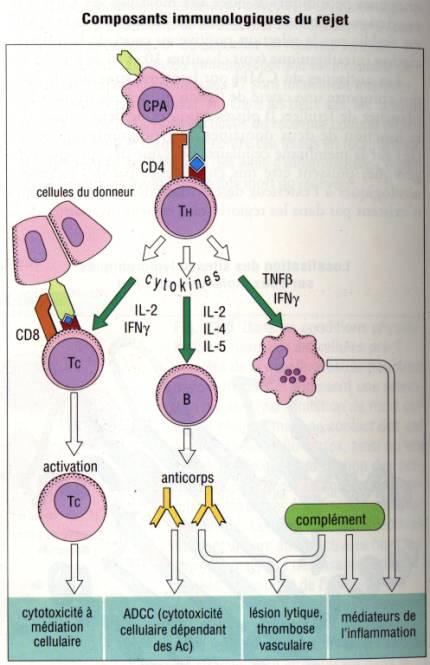
Figure :
Immunologie, I. Roitt, 1994 , DeBoeck Université
IV – Thérapeutiques
immunosuppressives
L'immunosuppression non spécifique atténue ou
supprime l'activité du système immunitaire quel que soit l’Ag. Si ce type de
thérapeutique est très efficace dans l'induction d'une immunosuppression il
n'en reste pas moins que ces traitements induisent de nombreux effets
secondaires infectieux notamment.
Les trois médicaments non spécifiques couramment
utilisés sont la cyclosporine, les corticoïde et l'azathioprine
Les corticoïdes
Sont actifs par leurs propriétés
anti-infiammatoire. Ils empêchent l'activation des CFA en diminuant
l'expression des molécules du CMH. Ils inhibent bon nombre des effets de l'IFN-g sur les CFA et le greffon.
La cyclosporine (et le FK506)
La cyclosporine est un macrolide d'origine fongique
produit par des micro-organismes du sol. L'effet principal de la cyclosporine
est d'inhiber la production de cytokine par les lymphocytes T CD4+ helper et
notamment la production d'IL-2.
L'azathioprine
Analogue de la 6-mercaptopurine. Son incorporation
dans l'ADN des cellules en division bloque la prolifération.
Chacun de ces médicaments est actif en monothérapie
mais seulement a forte doses, avec un risque d'effets secondaires importants.
Lorsqu'ils sont associés, il ont une action synergique en bloquant différentes
étapes de la réponse immune.
De nouveau médicaments non spécifiques mais plus
sélectifs sont en cours d'étude. Des Ac monoclonaux contre des molécules de
surface du lymphocyte : CD3, CD4, CD8 et le récepteur de I'IL-2 (CD25) peuvent
être administrés pour détruire les cellules ou bloquer leurs fonctions. On peut
coupler des molécules cytotoxiques à ces anticorps pour augmenter leur
efficacité. On peut aussi produire des molécules de fusion associant I'IL-2 à
une toxine.
Figure 11 : Thérapeutiques immunosuppressives
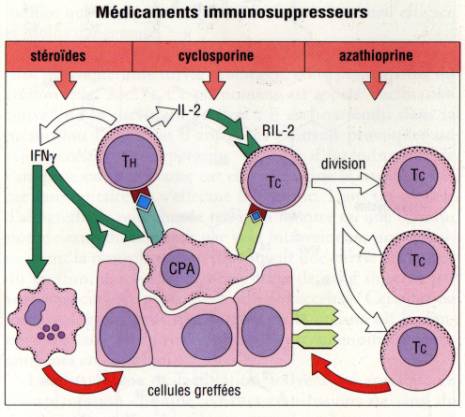
Figure :
Immunologie, I. Roitt, 1994 , DeBoeck Université
V – Les xénogreffes
Le nombre de donneurs étant insuffisant pour
subvenir aux besoins de greffe, on recherche actuellement, par des études
expérimentales, comment utiliser des organes d'animaux. Ces xénogreffes peuvent
être pratiquées entre espèce animales concordantes (entre espèce proche
phylogénétiquement ex : singe-homme) il s'en suit un rejet aigu rapide en
quelques jours. Les xénogreffes réalisées entre espèce animales discordantes on
observe alors un rejet suraigu en quelques minutes.
Le premier obstacle aux xénogreffes est dû à la
présence d'Ac naturels spécifiques (Ex : anti-Gal(a1-3Gal) qui se fixent sur l’endothélium du greffon
et entraînent un rejet suraigu par activation du système complément et coagulation
intra-vasculaire. Les recherches tentent d'identifier les molécules cibles de
ces anticorps et à modifier l’endothélium du greffon pour rendre sa surface
résistante à l'action du complément. L'une des possibilité est la création de
porcs transgéniques exprimant la molécule DAF et CD59 au niveau des cellules
endothéliales du greffon. Il semble que si l'on parvenait à empêcher le rejet immédiat
par les Ac et le complément, la réponse cellulaire T aux xénogreffes pourraient
être contrôlée par les même immunosuppresseurs que ceux utilisés pour prévenir
le rejet d'allogreffe.
