![]()

Chapitre 3
LE RECEPTEUR DE L’ANTIGENE DES
LYMPHOCYTES T
I – Introduction
Les lymphocytes T reconnaissent un antigène sous la forme d’un peptide fixé sur une molécule du complexe majeur d’histocompatibilité. Le complexe CMH-peptide est reconnu par un hétérodimère codé par des gènes réarrangés et exprimés seulement dans la cellule T. Cet hétérodimère fait en outre partie d’un complexe composé de 7 chaînes polypeptidiques insérées dans la membrane du lymphocyte T. Le récepteur des lymphocytes T a été identifié initialement par des anticorps monoclonaux anti-clonotypiques. Ces anticorps sont spécifiques d’un clone lymphocytaire T et sont capables d’inhiber la reconnaissance du complexe CMH-peptide spécifique par ce clone. Grâce à ces anticorps on a pu montrer que chaque cellule T présentait environ 30.000 récepteurs à sa surface. Chaque récepteur est constitué de deux chaînes liées l’une à l’autre par un pont disulfure. Ces hétérodimères sont très similaires au fragment Fab d’une immunoglobuline et appartiennent à la superfamille des immunoglobulines Ig).
Bien que l’utilisation des
anticorps anti-clonotypiques ait permis de déterminer de nombreuses
caractéristiques du récepteur pour l’antigène des lymphocytes T, la plupart de
ce que l’on connaît actuellement de la structure et de la fonction de ce
récepteur vient de l’étude des segments géniques codant les différentes chaînes
de l’hétérodimère. Très rapidement après sa mise en évidence par les anticorps
anti-clonotypiques, le récepteur T fut cloné en utilisant une stratégie
originale. Les lymphocytes B et T sont des cellules très proches, l’une des
différences étant que les lymphocytes B synthétisent des anticorps alors que
les lymphocytes T synthétisent des récepteurs T. De cette très forte
ressemblance, il résulte que 98% des ARNm cytosoliques sont identiques dans les
deux types de cellule. L’idée fut donc de cloner les ADNc provenant des ARNm
des cellules T qui ne s’hybrident pas avec les ARNm des cellules B (clonage soustractif).
Ces ADNc spécifiques des lymphocytes T devaient contenir en grande quantité
ceux qui codent le récepteur T. Les clones obtenus ont ainsi permis de
caractériser les gènes codant les différentes chaînes constituant le récepteur
des lymphocytes T.
Il existe deux types de cellules T définis par les chaînes présentes au sein du complexe hétérodimérique.
- Le TcR ab est un
hétérodimère constitué d'une sous-unité a
de 40 à 50 kDa et b de 35 à 47 kDa reliées entre
elles par un pont disulfure. Chaque chaîne polypeptidique comprend deux
domaines extracellulaires d'environ 110 acides aminés, analogues aux domaines
des Ig, ancrés dans la membrane par un peptide transmembranaire, suivi d'un
très court segment intra-cytoplasmique. La différence de poids moléculaire
entre les deux chaînes s'explique par la présence d'oligosaccharides
additionnels en liaison N sur la chaîne. La variabilité des séquences d'acides
aminés se situe dans les domaines N-terminaux des chaînes a et b
qui sont
homologues aux domaines variables des Ig. Ces domaines sont codés par des gènes
disposés en mosaïque qui subissent une réorganisation lors de l’ontogenèse des
lymphocytes T : gènes V, D et J pour le domaine Vb, et V et J pour le domaine Va.
En comparant les séquences des domaines V de différents TcR, on a observé des
régions de plus grande variabilité correspondant aux régions hypervariables des
Ig (CDR). Le pont disulfure qui associe les chaînes a et b
est situé dans des séquences peptidiques localisées entre les domaines constants
et les régions transmembranaires des deux chaînes. Ces dernières ont la
particularité de posséder des acides aminés positivement chargés qui jouent un
rôle dans l'assemblage et le transport intracellulaire des complexes TcR. Les
cellules T qui expriment l’hétérodimère ab
sont impliquées dans les fonctions régulatrices et effectrices de la réponse
immunitaire et sont spécifiques d'un antigène déterminé. Ces cellules T
répondent à l’antigène associé aux molécules de classe I et de classe II du CMH
en conjonction avec les co-récepteurs CD4 et CD8. L’analyse de nombreux TcR a
montré qu’il n’existait pas de différences majeures entre les TcR reconnaissant
des complexes peptide-CMH classe I ou peptide CMH classe II.
Figure 1 : Structure du TcR ab.
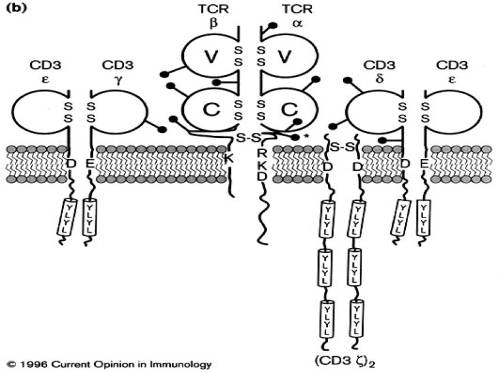
- La structure du TcR gd ressemble à celle de son homologue ab, chaque chaîne comportant des régions extracellulaires V et C, une région transmembranaire contenant des résidus de charge positive, et une courte région intracytoplasmique. Le récepteur gd humain est plus polymorphe que son homologue murin. Les chaînes g et d du récepteur humain peuvent être ou non associées par un pont disulfure selon que le récepteur est formé de chaînes g1 ou g2, l'exon Cg2 étant le seul à posséder un codon pour une cystéine. Les chaînes Cg2 peuvent, de plus, avoir une longueur variable du fait de la duplication ou de la triplication du second exon. On ne connaît pas les éventuelles conséquences fonctionnelles de ces différences structurales. Chez la souris, les chaînes g et d sont toutes associées par un pont disulfure.
Les lymphocytes portant des récepteurs ab ou gd ont des localisations histologiques différentes. Les cellules à TcR ab constituent plus de 95 % des lymphocytes T périphériques ainsi que la majorité des thymocytes ayant un TcR. Les lymphocytes T à TcR gd sont minoritaires dans le thymus et les organes lymphoïdes secondaires, mais plus abondants dans les épithéliums tels que l'épiderme, les muqueuses buccales, utérines et intestinales.
Selon leur localisation histologique, les lymphocytes T à TcR gd expriment des régions V différentes. Les lymphocytes T gd semblent répondre à des déterminants antigéniques viraux et bactériens hautement conservés exprimés par les micro-organismes au cours du stress et de l’inflammation. Il a été suggéré que les lymphocytes gd constituaient la première ligne de défense contre les agents infectieux.
II - Organisation des gènes codant les chaînes a et b du TcR
L'organisation des gènes codant les chaînes a et b
du TcR est assez semblable à celle des gènes codant les Ig. Les gènes codant
les chaînes a sont constitués de 70 à 80
segments variables chacun contenant un exon codant la région variable précédée
d'un exon codant une séquence signal permettant le ciblage de la protéine vers
le réticulum endoplasmique et son expression à la surface de la cellule. En 3'
des gènes V se trouvent les gènes de jonction J. Les gènes J sont au nombre de
61 pour la chaîne a du TcR alors qu'ils sont au
nombre de 5 au niveau du locus codant les chaînes légères des Ig.
Certains gènes Ja sont
défectifs soit qu'ils comportent un codon stop dans leur séquence, soit qu'ils
ne possèdent pas de séquences heptamériques ou nonamériques en 3' ou en 5'. En
aval des gènes J se trouve l'unique gène C. Il est composé de quatre exons
codant le domaine constant de la chaîne a, la région charnière
porteuse du pont disulfure associant les chaîne a et b, la
région transmembranaire et cytoplasmique.
L'organisation des gènes codant la chaîne b est légèrement différente. En effet, il existe une cinquantaine de gènes V fonctionnels situés en amont de deux groupes de gènes contenant chacun un seul gène D associé à 6 ou 7 gènes J et à un gène C unique codant la partie constante de la chaîne. Chaque gène C contient des exons codant les parties constantes, charnière, transmembranaire et cytoplasmique des chaînes b.
Les principales différences entre les gènes codant les Ig
et ceux codant le TcR reflètent la diversité des fonctions exercées par les
lymphocytes B et T. Ainsi, les fonctions effectrices des cellules B dépendent
de la synthèse et de la sécrétion d'Ig dont l'isotype des chaînes constantes
est susceptible d'activer des mécanismes effecteurs variés. Au contraire, les
fonctions effectrices des lymphocytes T dépendent de contacts intercellulaires
et non directement de la structure particulière du récepteur T qui n'exerce
dans ce cas qu'une fonction de reconnaissance. Ainsi, les régions constantes
des gènes codant le récepteur T sont beaucoup plus simples que ceux codant les
Ig. Il n'existe qu'un seul gène Ca
et, bien qu'il existe deux gènes Cb,
leurs produits ne présentent aucune différence fonctionnelle. Les régions
constantes des chaînes du TcR codent seulement pour des protéines
transmembranaires, il n'existe aucun exon codant une forme sécrétée.
Figure 2 : Organisation des gènes codant les chaînes a et bdu TcR.
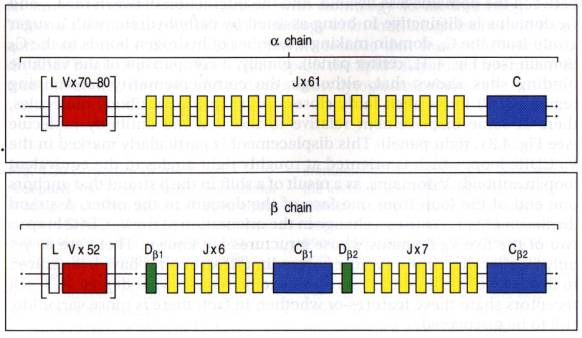
Photo : Immunobiology, 1998, CA. Janeway.
Ed Garland Publishing
III - Réarrangement des chaînes a et b du TcR
A - Organisation des locus a et b.
Les chaînes a et b du TcR sont composées de segments géniques qui sont joints par recombinaisons somatiques durant le développement des cellules T.
Pour les chaînes a, un segment génique Va se réarrange avec un gène de jonction Ja créant ainsi un exon fonctionnel. Son association avec le gène Ca génère un ARNm qui après traduction donnera naissance à la chaîne a.
Pour les chaîne b,
le domaine variable est codé par trois segments géniques : V, D et J.
L'association par recombinaisons somatiques aléatoires de ces trois segments
crée un exon fonctionnel VDJb qui après
traduction et excision est associé au segment génique Cb. C'est cet ensemble qui donnera naissance à la
chaîne b. Les chaînes a et b
ainsi synthétisées forment le récepteur hétérodimérique T.
Figure 3 : Réarrangement des chaînes a et bet synthèse du TcR.
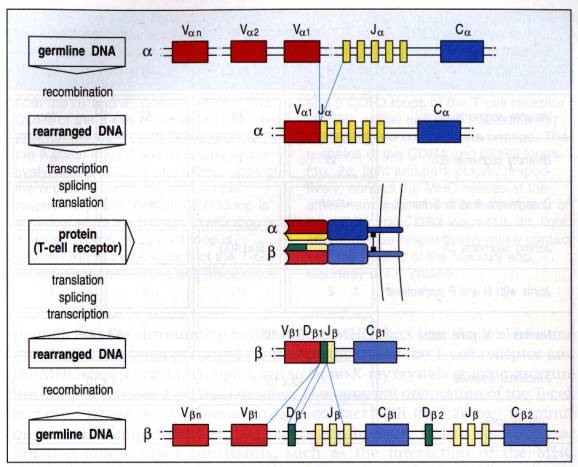
Photo : Immunobiology, 1998, CA. Janeway.
Ed Garland Publishing
Tout comme pour les Ig, les
segments géniques codant les chaînes du TcR sont entourés de séquences particulières
de recombinaison. Ainsi, la recombinaison V/J s'explique par l’existence de
séquences complémentaires. Ces séquences sont constituées d'un heptamère et
d'un nonamère séparés par 23 paires de bases immédiatement en 5' du gène V et
par 12 paires de bases en 5' du gène J. Les deux heptamères et les deux
nonamères s'associent, ce qui a pour effet de mettre exactement bout à bout les
gènes V et J. Une recombinase qui reconnaît ce motif assure la ligation des
gènes V et J. Dans la pratique, trois mécanismes au moins sont utilisés. Le
premier correspond à celui de la recombinaison intra-chromosomique utilisée
pour les gènes des Ig. Cependant, pour le récepteur T, l'ADN séparant V et J
est souvent récupéré et réinséré ailleurs dans le génome au lieu d'être
simplement délété. Le second mécanisme correspond à un échange inégal entre
chromatides sœurs. Il s'agit là d'une recombinaison non plus
intra-chromosomique mais inter-chromosomique. Le dernier mécanisme utilisé est
l'inversion. Ce mécanisme a été suggéré par l'observation que l'un des gènes Vb (Vb14) est
situé en 3' du gène codant la partie constante et possède un sens de
transcription opposé. Comme ce gène est exprimé normalement, il ne peut l'être
qu'après une recombinaison impliquant une inversion. L'importance relative de
ces trois mécanismes n'est pas connue.
Figure 4 : Association heptamère-nonamère.

B - Etapes enzymatiques des réarrangements des gènes du TcR.
Certaines enzymes spécialisées
sont nécessaires aux recombinaisons somatiques des gènes V. Les différentes
enzymes agissant de concert pour effectuer la recombinaison des gènes V sont
appelées recombinases VDJ. Ce complexe est constitué principalement d'enzymes
de clivage et de réparation de l'ADN présentes dans de nombreux types
cellulaires et nécessaires à la maintenance de l'ADN nucléaire. Toutefois, la
première étape de clivage nécessite une endonucléase hétérodimérique
spécialisée produite par deux gènes appelés RAG-1 et RAG-2. Les deux gènes RAG-1 et RA-2 sont
exprimés dans les lymphocytes au cours de leur développement. Les souris
invalidées ("knock out", RAG-/-) pour ces gènes souffrent d'un
blocage du développement primaire des lymphocytes B et T au stade des
réarrangements des gènes VDJ et sont dépourvues de récepteurs d'antigènes.
La
terminodeoxynucleotidyltransférase (TdT) est une autre enzyme du complexe
recombinase qui permet l'addition de nucléotides au niveau des jonctions DJ.
L'ADN ligase IV, la DNA-dependent protéine kinase et Ku sont, quant à elles,
spécialisées dans la réparation des doubles brins d'ADN. Ku est un hétérodimère
de 70 et 80 kD qui s'associe fortement avec la DNA-PK. Les souris déficientes en DNA-PK
sont incapables de joindre l'ADN au niveau des gènes des régions variables. Ces
animaux souffrent d'un déficit immunitaire combiné sévère (souris SCID).
Figure 5 : Etapes enzymatiques des réarrangement des gènes du TcR.
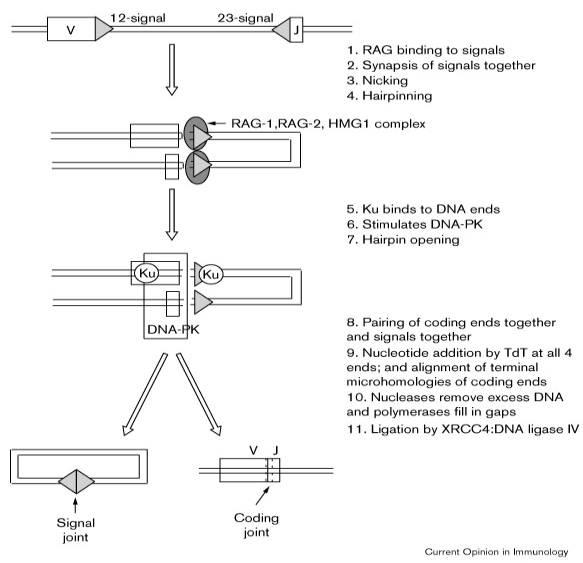
Les réarrangements débutent avec
l'action du complexe RAG1/RAG2 qui reconnaît les séquences signal de
recombinaison (heptamère-nonamère). RAG1 et RAG2 coupent un brin de l'ADN à la
fin de la séquence heptamérique. L'extrémité 5' du brin coupé réagit
immédiatement avec le brin complémentaire et le sectionne, donnant naissance à
une coupure double brin à la fin de la séquence heptamérique. Les deux brins de
la double hélice se joignent pour former une " épingle à
cheveux " (" hairpin "). De façon concomitante,
les deux séquences heptamériques se rejoignent pour former la séquence
"signal" qui est éliminée. Des endonucléases simple brin coupent les
"hairpins" à un site aléatoire formant alors des extrémités à simple
brin qui contiennent des nucléotides préalablement complémentaires sur l'ADN
double brin formant ainsi des motifs palyndromiques. Ces nucléotides qui sont
originaires du brin complémentaire d'ADN sont appelés P-Nucléotide
(template-dependent). L'enzyme TdT agit à ce niveau en ajoutant des nucléotides
à l'extrémité 3' des simples brins d'ADN. Ces nucléotides sont appelés
N-Nucléotides. (Template-independent). Les deux simples brins d'ADN
s'associent, des exonucléases éliminent les nucléotides non associés,
finalement, des polymérases resynthétisent la double hélice d'ADN.
Figure 6 : Diversité jonctionelle.
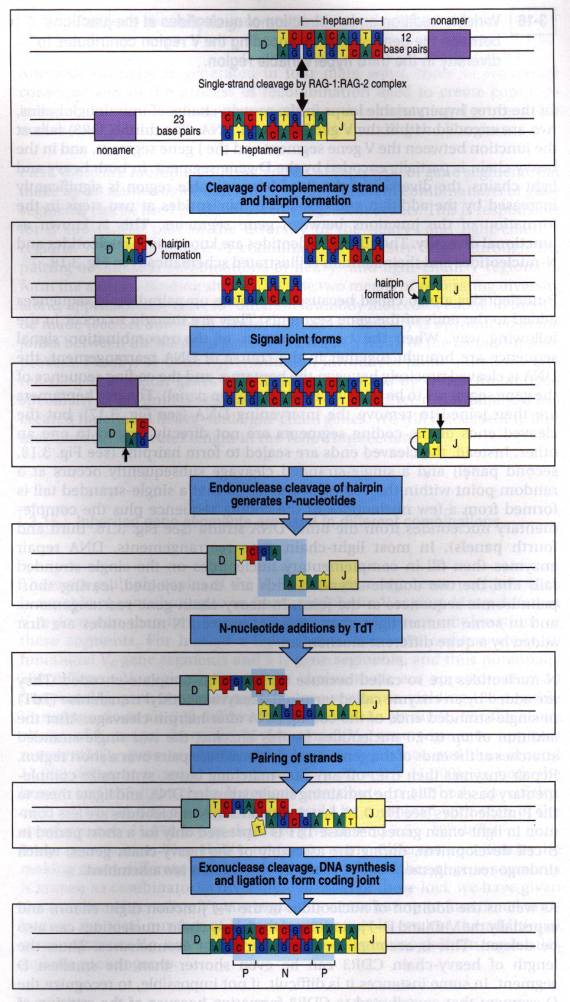
Photo : Immunobiology, 1998, CA. Janeway.
Ed Garland Publishing
IV - Diversité du TcR
A - Rôle du CDR3 dans la diversité du TcR
Alors que les anticorps doivent interagir avec une variété quasi infinie d'antigènes d'épitopes conformationnels, le ligand du récepteur T est toujours une molécule de CMH. La variabilité du TcR doit être restreinte à la zone de contact avec le peptide antigénique présent dans le sillon de la molécule de CMH.
La structure tridimensionnelle du site de reconnaissance de l'antigène des lymphocytes T ressemble fortement à celui d'une Ig. Au niveau des chaînes a et b du TcR, le CDR3 forme le centre de reconnaissance de l'antigène. Les boucles CDR1 et CDR2 codées par les gènes V des chaînes a et b sont localisées à la périphérie du site de reconnaissance. Le TcR et les Ig ont à peu près le même nombre de gènes V, mais seules les Ig peuvent subir des modifications de leurs gènes V par mutations somatiques. Ceci explique que la diversité des CDR1 et des CDR2, localisés à la périphérie du site de reconnaissance de l'antigène sera bien plus grande dans la molécule d'Ig que dans la molécule de TcR. La diversité du TcR est due uniquement à la diversité combinatoire et jonctionnelle générée durant les réarrangements.
La variabilité des TcR est localisée essentiellement au niveau des zones de jonction V, D et J. Le fait que la chaîne a possède un grand nombre de gènes J et que les deux segments D puissent se joindre l'un à l'autre dans la chaîne b augmente fortement la variabilité du CDR3. Ainsi, le centre du TcR est hautement variable alors que la périphérie du site de reconnaissance de l'antigène (CDR1 et CDR2) est le siège de peu de variations.
B - Diversité du TcR. Absence de mutations somatiques
Au cours de la réponse humorale, les mutations somatiques
augmentent la diversité des régions CDR1, 2 et 3 des immunoglobulines. Ce
phénomène ne se produit pas pour le récepteur des cellules T. La variabilité
des CDR1 et 2 est donc limitée à celle des différents gènes V dont ils
proviennent, la diversité du TcR étant portée exclusivement par le CDR3.
Cette différence entre
lymphocytes B et T n'est pas claire et plusieurs explications peuvent être
suggérées sur la base des différences fonctionnelles entre ces deux types
cellulaires. Premièrement, les cellules T ont un rôle central dans l'induction
d'une réponse cellulaire et humorale. Il est donc fondamental que les cellules
T ne réagissent pas contre les composants du soi. Les cellules T autoréactives
sont éliminées au cours du développement thymique. L'absence de mutations
somatiques permet d'éviter qu'au cours de la réponse immune des mutants générés
par ce mécanisme puissent reconnaître des antigènes du soi. Ce phénomène
s'applique moins aux lymphocytes B car ces cellules nécessitent la coopération
de lymphocytes T pour sécréter leurs Ig. Le deuxième argument majeur est que la
cellule T reconnaît des peptides fixés sur la molécule de CMH. Les
hypermutations des CDR1 et 2 pourraient inhiber l'interaction de ces régions
avec la molécule de CMH.
C - Cas des superantigènes
La reconnaissance d'un antigène par une cellule T
n'implique pas toujours la présentation d'un peptide antigénique présent dans
le sillon d'une molécule de CMH. En effet, certains antigènes ont des
propriétés de fixation sur les molécules de CMH particulières. Ces antigènes
sont appelés superantigènes et sont capables d'activer un grand nombre de
lymphocytes T différents. Les superantigènes sont produits par de nombreux
micro-organismes. Ils se fixent directement sur la molécule de CMH sans avoir subi
d'apprêtement préalable. Le superantigène interagit avec d'une part la face
externe et le sillon de la molécule de CMH et d'autre part directement avec la
région Vb du récepteur T. Ainsi, les
régions Va et le CDR3 de la chaîne b du TcR n'ont aucun rôle dans la reconnaissance du
superantigène, qui est essentiellement conditionnée par le type de Vb exprimé par le TcR. Chaque superantigène peut
interagir avec un ou plusieurs Vb
différents. De ce fait, un superantigène peut stimuler jusqu'à 20% de tous les
lymphocytes T. Ce mode de stimulation n'induit pas une réponse adaptative
spécifique du pathogène. Elle conduit, au contraire, à la production massive de
cytokines par les lymphocytes T CD4+, qui entraîne deux effets majeurs : une toxicité
systémique et la suppression de la réponse immunitaire adaptative par délétion
de l'ensemble des cellules T porteuses du Vb
activées par le superantigène. Ces deux effets contribuent à accroître le
pouvoir pathogène du micro-organisme.
Figure 7 : Superantigènes.
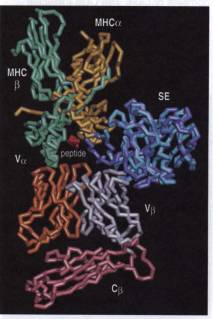
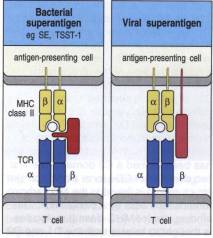
Photo : Immunobiology, 1998, CA. Janeway.
Ed Garland Publishing
V - Rôle des co-récepteurs CD4 et CD8
A - Introduction
Il existe deux grandes classes de cellules T qui se distinguent par le type de molécules de CMH qu'elles reconnaissent. Ces cellules T ont des fonctions effectrices différentes et expriment de façon mutuellement exclusive le CD4 ou le CD8. Les molécules de CD4 et de CD8 ne sont pas seulement des marqueurs de différenciation des lymphocytes T; ces protéines participent activement à la reconnaissance des molécules de CMH de classe I pour le CD8 et des molécules de CMH de classe II pour le CD4. En effet, le CD4 et le CD 8 se lient respectivement à des régions invariantes des molécules de CMH de classe II et I. Au cours de la reconnaissance de l'antigène, les co-récepteurs CD4 et CD8 s'associent au TcR favorisant ainsi l'interaction entre le TcR et le complexe CMH-peptide.
B - La molécule CD4
Le CD4 est une molécule composée de quatre domaines de
type Ig.
Les deux premiers domaines (D1
et D2) sont solidement associés l'un à l'autre formant ainsi une structure
rigide de 60Å de long. D1 et D2 sont reliés par une région charnière flexible
aux deux autres domaines D3 et D4 qui forment eux aussi une structure rigide
ancrée à la membrane. La région intracytoplasmique du CD4 interagit fortement
avec la protéine tyrosine kinase p56Lck. Cette propriété permet à la molécule
de CD4 de participer activement à la transduction du signal des lymphocytes T
auxiliaires. Le CD4 interagit avec le domaine b2 de la molécule de classe II du
CMH par l'intermédiaire de ses deux domaines D1 et D2.
C - La molécule CD8
Bien que le CD4 et le CD8 agissent tous deux comme co-récepteurs
du TcR, leur structure est très différente. La molécule de CD8 est un
hétérodimère composé d'une chaîne a
et b constituées d'un domaine unique
de type Ig. Chaque domaine des chaînes a
et b est ancré à la membrane par une
grande chaîne peptidique fortement glycosylée. Le CD8 se fixe sur le domaine a3 des molécules de classe I du CMH. Comme le CD4,
la partie intracytoplasmique de la chaine a
du CD8 permet le recrutement de la p56Lck.
Figure 8 : Co-récepteurs CD4 et CD8.
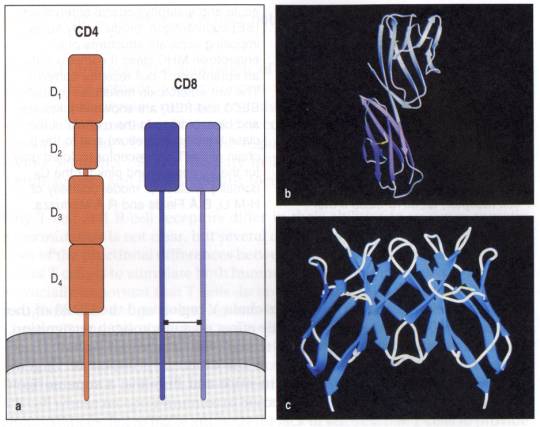
Photo : Immunobiology, 1998, CA. Janeway.
Ed Garland Publishing