![]()

Chapitre 5
SIGNAUX INTRACELLULAIRES
D’ACTIVATION DES LYMPHOCYTES T
I – Introduction
Les lymphocytes T reconnaissent les antigènes par leur TcR. Ce signal de reconnaissance extracellulaire doit être converti en une série de signaux intracellulaires. Ce phénomène est appelé transduction du signal. Le signal intracellulaire active différentes voies à l’intérieur de la cellule dont l’étape ultime est le noyau où l’activation de facteurs de transcription va induire l’expression de certains gènes.
II – Structure du récepteur de l’antigène et voies de signalisation.
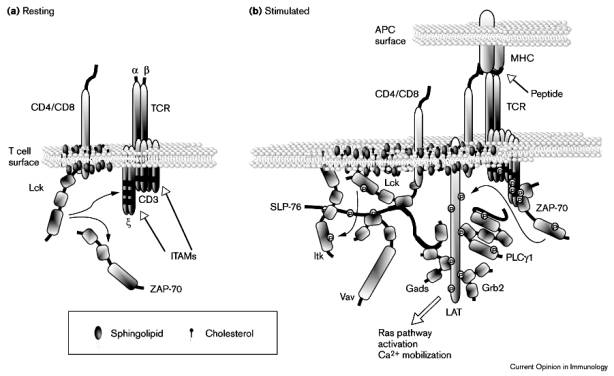
Le récepteur pour l’antigène des lymphocytes T est un complexe multiprotéique composé d’une unité de reconnaissance : l’hétérodimère ab associé à des protéines accessoires impliquées dans le déclenchement de la transduction du signal. Ces protéines forment le complexe CD3 composé lui-même de plusieurs chaînes distinctes : CD3e, CD3d, CD3g et CD3z. La stoïchiométrie du complexe n’est pas clairement définie, toutefois, il semble que chaque unité de reconnaissance ab soit associée avec deux hétérodimères CD3e/CD3d et CD3g/CD3e. Le complexe CD3 est indispensable à l’expression membranaire des chaînes ab et à la transduction du signal par le TcR. Les différentes molécules de CD3 ressemblent aux Iga et aux Igb du BcR. Elles comportent dans leur région intracytoplasmique des motifs ITAM (" immunoreceptor tyrosine-based activation motif "). Ces ITAM ont une structure particulière. Ils sont composés de deux tyrosines séparées par 13 acides aminés.
Lorsque l’antigène se fixe sur son récepteur, ces
tyrosines sont phosphorylées par les protéines tyrosine kinases associées aux
co-récepteurs CD4 et CD8. La séquence canonique des ITAM est YXX[L/V]X7-11YXX[L/V]
où Y est une tyrosine, L une leucine, V une valine et X n’importe quel acide
aminé. Si les CD3 d, e et g possèdent un seul motif ITAM dans
leur région intracytoplasmique, ce motif est répété trois fois dans la chaîne z du CD3. Ainsi, le TcR est associé à 10 motifs
ITAM. La cohésion du complexe est assuré par la présence de résidus chargés
négativement au niveau de la région transmembranaire des chaînes du CD3 qui
peuvent interagir avec les résidus chargés négativement présents dans les
régions transmembranaires des chaînes a
et b du TcR.
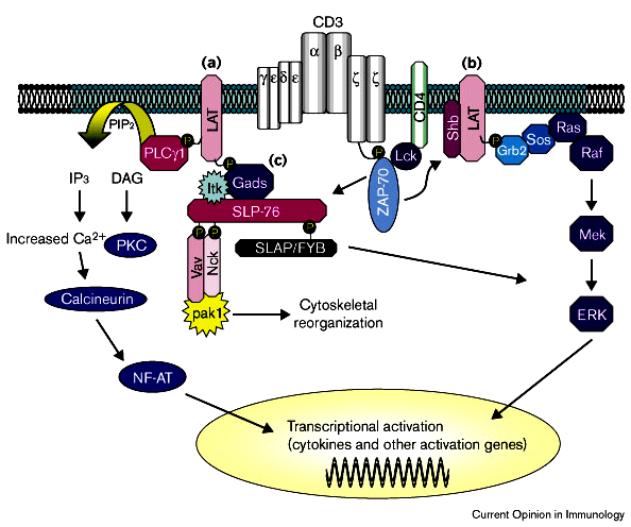
Figure 1 : Rôle des ITAM dans l’activation des lymphocytes T.
III – Protéines tyrosine kinase de la famille Src. : p56Lck et
de la famille Syk : Zap-70
Ces protéines possèdent un domaine
aminoterminal appelé domaine unique propre à chaque membre de la famille Src.
Pour p56Lck, ce domaine permet l’association au CD4 et au CD8. Cette
interaction permet le recrutement de la p56Lck au niveau de la face interne de
la membrane du lymphocyte T. En aval de cette région, on trouve le domaine SH3
qui permet l’association des protéines de la famille Src sur des motifs riches
en proline. Adjacent au domaine SH3, on trouve le domaine SH2 composé de deux
poches présentant une sélectivité pour les tyrosines phosphorylées et l’acide
aminé en +3 de cette tyrosine. Les protéines kinases de la famille Src se
composent en outre d’un domaine catalytique comportant une tyrosine activatrice
en 394 controlant l’accès des substrats au site catalytique. Enfin, l’extension
terminale possède une tyrosine inhibitrice en 505. L’activité enzymatique des
protéines de la famille Src est donc finement régulée par la phosphorylation
des deux tyrosines ayant respectivement des activité activatrice et
inhibitrice. La phosphorylation de la tyrosine inhibitrice C terminale par la
protéine kinase Csk (C terminal Src kinase) inactive les Src kinases.
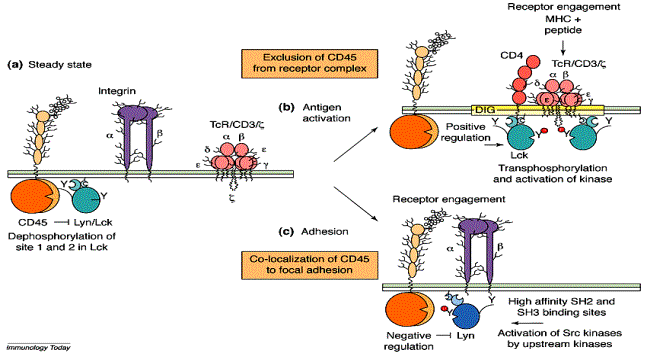
L’activité Csk est constitutive dans les cellules au repos. La protéine
phosphatase transmembranaire CD45 permet de contre-balancer l’effet de Csk en
déphosphorylant préférentiellement la tyrosine inhibitrice. Finalement, au
repos les deux tyrosines sont déphosphorylées.
Lorsque le TcR se fixe sur le
complexe CMH-peptide, des modifications de la structure membranaire au niveau
du TcR excluent CD45 ce qui a pour effet la phosphorylation de la tyrosine
activatrice de la p56Lck. De plus, la fixation du co-récepteur CD4 et CD8 sur
les régions conservées du CMH met en contact la protéine tyrosine kinase p56Lck
sous forme activée en contact avec les ITAM des chaînes intracytoplasmiques du
CD3. La phosphorylation des ITAM conduit au recrutement d’une protéine
cytoplasmique à activité tyrosine kinase : Zap-70. Zap-70 est une protéine
de la famille Syk. Zap-70 possède deux domaines SH2 spécifiques des ITAM
phosphorylés et un domaine catalytique C terminal. Zap-70 se fixe sur les ITAM
phosphorylés du CD3z, p56Lck peut alors phosphoryler le domaine catalytique de
Zap-70 et l’active.
Figure 2 : Relation structure/activité des protéines kinase de la famille Src.
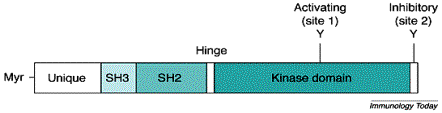
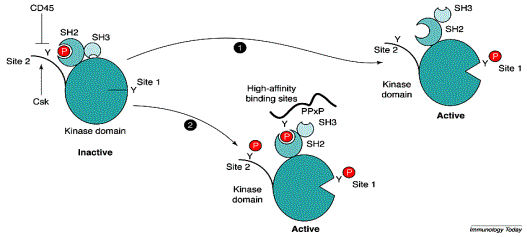
Figure 3 : Rôle du CD45 dans l’activation lymphocytaire.
VI – Voies de signalisation en aval de Zap-70
La propagation du signal en aval
de Zap-70 implique trois grandes voies. La phospholipase Cg (PLCg) possède
deux domaines SH2 qui permettent son recrutement au niveau de la sous membrane.
La phosphorylation le la PLCg clive le phosphatidyl inositol biphosphonate
(PIP2) en diacylglycérol (DAG) et en inositol triphosphate (IP3). Le DAG active
la protéine kinase C elle même responsable de l’activation du facteur de
transcription NF-kB. IP3 augmente la concentration intracellulaire de calcium
ce qui a pour effet d’activer la calcineurine. La calcineurine est une
phosphatase qui déphosphoryle le facteur de transcription NF-AT et permet sa
translocation dans le noyau. Enfin, la troisième voie activée par la
phosphorylation de Zap-70 est celle qui fait intervenir les petites
protéines G (p21Ras). Les guanine-nucléotide exchange factors (GEF) sont
phosphorylés et activés par Zap-70. ). p21Ras existe sous deux formes :
une forme inactive GDP-Ras et une forme active GTP-Ras. Après leur
phosphorylation par Zap-70, les GEF permettent la phosphorylation de GDP-Ras en
GTP-Ras. Une fois activée, p21Ras active la cascade des MAP kinase
(" mitogen-activated protein kinase "). La cascade des MAP
kinases aboutit à l’activation de facteurs de transcription comme AP-1.
Figure 4 : Voies d’activation en aval de ZAP-70.