![]()

Chapitre 15
IMMUNITE ANTI INFECTIEUSE
PRECOCE
REPONSE INFLAMMATOIRE
I – Introduction
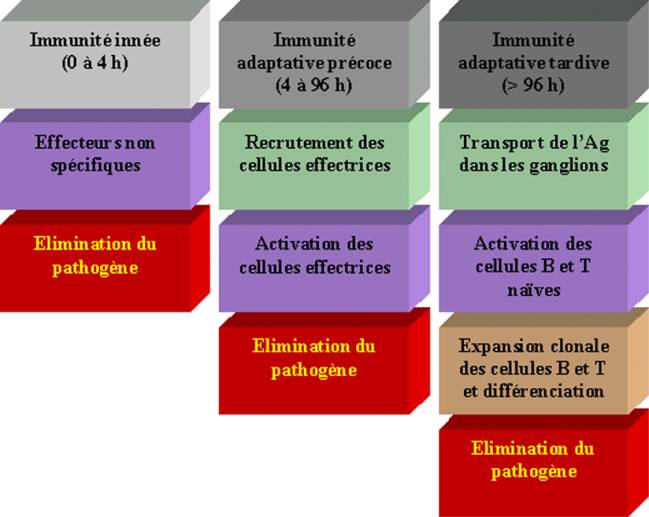
Les micro-organismes pathogènes rencontrés chaque jour par un individu sain ne causent qu’occasionnellement une maladie. La plupart des micro-organismes sont détectés et détruits rapidement par des mécanismes de défense innés. Ceux-ci peuvent être rapidement engagés pour lutter contre l’infection car ils ne nécessitent pas l’expansion clonale des lymphocytes spécifiques d’un antigène particulier. Si le micro-organisme submerge cette première ligne de défense, se développe alors une réponse immunitaire adaptative conduisant à la génération de cellules effectrices spécifiques du pathogène et de cellules mémoires capables de prévenir une infection ultérieure par le même micro-organisme.
Les mécanismes impliqués dans l’immunité innée (naturelle) agissent immédiatement après l’invasion par le pathogène. Après quelques heures, la première phase est rapidement suivie d’une réponse immunitaire précoce adaptative. Ces phases précoces permettent de contrôler l’infection avant que les lymphocytes spécifiques de la réponse immunitaire adaptative ne soient générés.
Les cytokines produites au cours de la réponse
immune innée peuvent jouer un rôle déterminant dans le développement ultérieur
de la réponse immunitaire adaptative en dirigeant celle-ci vers une réponse de
type cellulaire ou humorale.
Figure 1 : Différentes phases de l’immunité anti-infectieuse.
II – Infection et immunité innée
A
– Protection physique
La première ligne de défense contre les micro-organismes
pathogènes est constituée par les barrières anatomiques destinées à
empêcher leurs pénétration et le développement d’une infection. C’est ainsi que
la peau et les surfaces muqueuses ont des systèmes de protection qui s’opposent
à la pénétration des micro-organismes. C’est seulement une infime portion des
micro-organismes pathogènes de notre environnement qui peut atteindre nos
tissus.
Figure 2 : Protection physique et infection.
B –
Activation du complément par la voie alterne
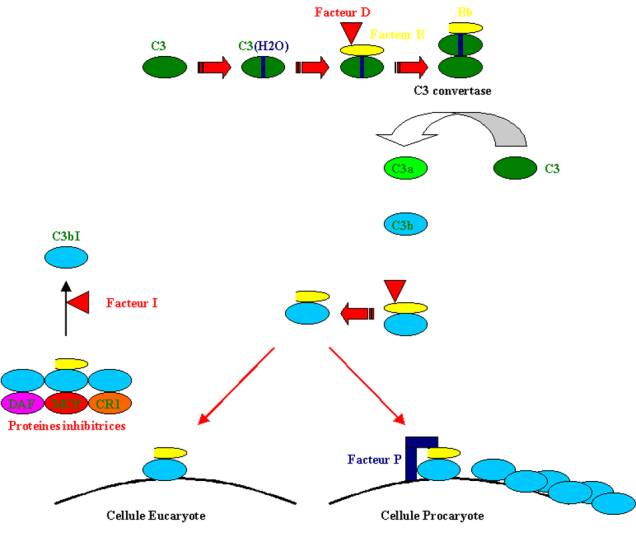
L’activation du complément par la voie alterne permet de détruire les micro-organismes en épargnant les cellules de l’hôte qui sont protégées des effets néfastes du complément par des protéines régulatrices.
La liaison thio-ester du C3 natif est hydrolysée
spontanément dans le plasma pour donner naissance au C3(H2O) (C3i). Ce composé
se fixe au facteur B en présence d’ion Mg2+, ce qui, à la suite du
clivage du facteur B par le facteur D, forme la C3 convertase qui peut alors
directement cliver le C3 en C3a et C3b. Une partie du C3b peut se lier de façon
covalente aux surfaces adjacentes. Le C3b peut alors agir comme un site de
fixation pour d’autres molécules de facteur B ce qui amorce la boucle
d’amplification. Ce système d’activation provoque la fixation indiscriminée de
C3b sur n’importe quelle surface adjacente. Cependant, il existe, à la surface
des cellules, des molécules qui empêchent la formation de la C3 convertase
stable. Le facteur H plasmatique, le complément récepteur 1 (CR1) et le
decay-accelerating factor (DAF) dissocient le C3b de Bb. De plus, le facteur H,
le CR1 et le " membrane cofactor of proteolysis " (MCP)
catalysent le clivage du C3b fixé par le facteur I produisant un C3bi inactif.
Les surfaces bactériennes n’expriment pas les protéines régulatrices du
complément. Au contraire, les surfaces bactériennes fixent le facteur P
(properdine) qui stabilise l’activité C3 convertase. Il en résulte une
opsonisation de la surface bactérienne par le C3b et la formation du complexe
(C3b)2Bb à activité C5 convertase. Cette dernière aboutit à la
formation du complexe d’attaque membranaire.
Figure 3 : Activation du complément par la voie alterne.
C – Rôle des
cellules phagocytaires
Les macrophages se différencient à partir des monocytes du sang circulant. On les trouve en grande quantité dans le tissu conjonctif au niveau du tractus gastro-intestinal, du poumon, du foie et de la rate.
Les polynucléaires neutrophiles sont produits par la moelle osseuse en quantité abondante chaque jour. Ces deux classes de phagocytes jouent un rôle clé dans la défense de l’organisme contre l’infection par les micro-organismes pathogènes.
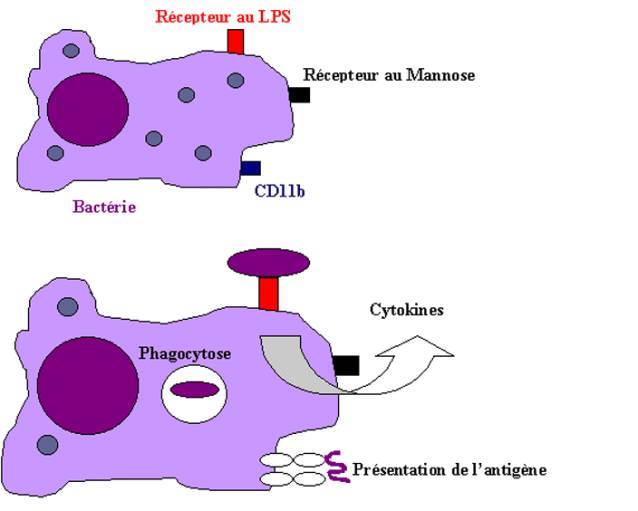
Ces cellules peuvent en effet phagocyter de nombreux pathogènes directement ou après leur opsonisation par des anticorps ou des protéines du complément. La phagocytose directe des micro-organismes par les phagocytes implique des récepteurs sur la cellule reconnaissant des structures spécifiques à la surface du pathogène. Ainsi, le récepteur CD11 des macrophages peut interagir avec le LPS bactérien, le lipophosphoglycane de Leishmania, l’hemagglutinine de Bordetella et certaines structures des Candida et des Histoplasmes. D’autres récepteurs du macrophage comme le récepteur au mannose, les récepteurs " nettoyeurs " (" scavengers ") ou le CD14 peuvent aussi interagir avec certains constituants communs à de nombreux micro-organismes.
Lorsque le pathogène traverse la barrière épithéliale, il
est immédiatement reconnu par les phagocytes présents dans le tissu conjonctif
sous-épithélial. Ce phénomène de reconnaissance a trois conséquences
majeures : la première est la capture, la phagocytose et la dégradation
du micro-organisme ; la seconde est la production de cytokines par
le phagocyte ; la troisième est la présentation de peptides dérivés
des antigènes du micro-organisme, complexés aux molécules de classe II du CMH
aux lymphocytes T naïfs, ainsi que l’induction à la surface du macrophage de
molécules de co-stimulation.
Figure 4 : Rôle des cellules phagocytaires.
III – Réponse non adaptative de l’hôte à
l’infection
A
– Introduction
L’activation du complément par la voie alterne et la phagocytose des pathogènes par les phagocytes a lieu dans les premières heures qui suivent l’infection. Si le micro-organisme échappe à ces mécanismes de défense innée, l’infection peut tout de même être maîtrisée par une deuxième vague de défense impliquant l’activation d’une grande variété de mécanismes effecteurs tant humoraux que cellulaires. Contrairement à la réponse immunitaire adaptative, ces réponses impliquent des mécanismes de reconnaissance du pathogène utilisant des récepteurs peu variables, généralement non spécifiques d’un micro-organisme particulier. De plus, l’activation de ces mécanismes n’induit pas de mémoire immunitaire susceptible de protéger l’individu contre une ré-infection par le même micro-organisme.
La réponse immunitaire précoce innée est importante à deux titres. Premièrement, elle peut contrôler l’infection par un micro-organisme jusqu’à la mise en place de la réponse adaptative. Deuxièmement, elle peut influencer, notamment par le biais des cytokines produites, le type de réponse adaptative induite (cellulaire ou humorale).
B
– La réponse inflammatoire
B
– 1 – Définitions
Une des fonctions importante de la réponse innée est de
recruter sur le site de l’infection un grand nombre de cellules phagocytaires et
de molécules effectrices. Ce recrutement est permis par la sécrétion de
cytokines par les cellules impliquées dans l’immunité innée. Les cytokines
ainsi produites en réponse à une infection sont l’IL-1, l’IL-6, l’IL-8, l’IL-12
et le TNF-a. Ces cytokines exercent des
actions locales et systémiques.
Figure 5 : Cytokines et réponse inflammatoire.
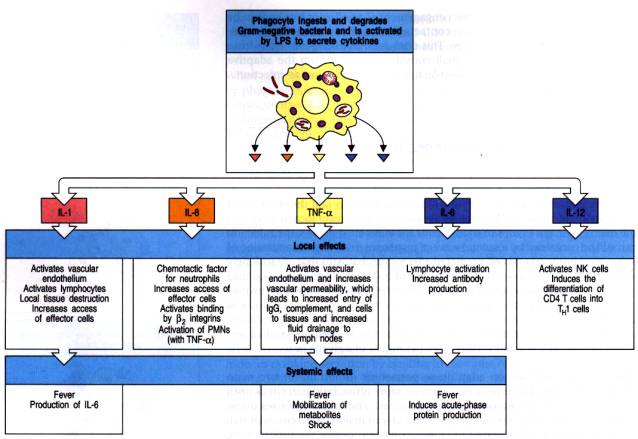
Photo :
Immunobiology, 1998, CA. Janeway, Ed Garland Publishing
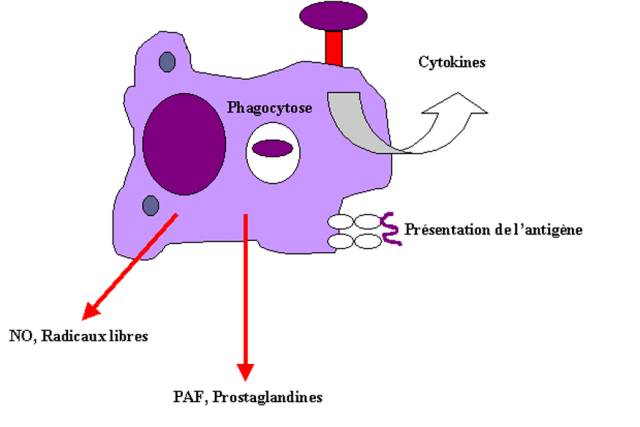
D’autres molécules sont également sécrétées par les
phagocytes en réponse aux agents infectieux. Ainsi, les macrophages produisent
des radicaux activés de l’oxygène, du monoxyde d’azote et des peroxydes, des
médiateurs lipidiques de l’inflammation comme les prostaglandines, les
leukotriènes et le PAF.
Figure 6 : Activation macrophagique et réponse inflammatoire.
La libération des composés C3a et surtout C5a favorise l’activation et le chimiotactisme des cellules phagocytaires tout en activant les mastocytes, ce qui favorise la libération d’histamine et, par voie de conséquence, augmente le flux sanguin et la perméabilité vasculaire.
La combinaison des effets locaux de ces différents médiateurs induit une réponse inflammatoire. Cette réaction se caractérise par une douleur, une rougeur et un œdème chaud sur le site de l’infection. Ces phénomènes reflètent deux types de modifications au niveau de l’endothélium vasculaire.
Le premier correspond à une vasodilatation entraînant l’augmentation du flux sanguin expliquant ainsi la chaleur et la rougeur observée au site inflammatoire. En outre, la vasodilatation diminue la vitesse du sang dans les vaisseaux. Ce phénomène favorise le contact des leucocytes avec les cellules de l’endothélium vasculaire. L’augmentation de la perméabilité vasculaire conduit à l’œdème, donc à la douleur et favorise le passage de molécules effectrices comme les immunoglobulines et les protéines du complément au lieu de l’infection.
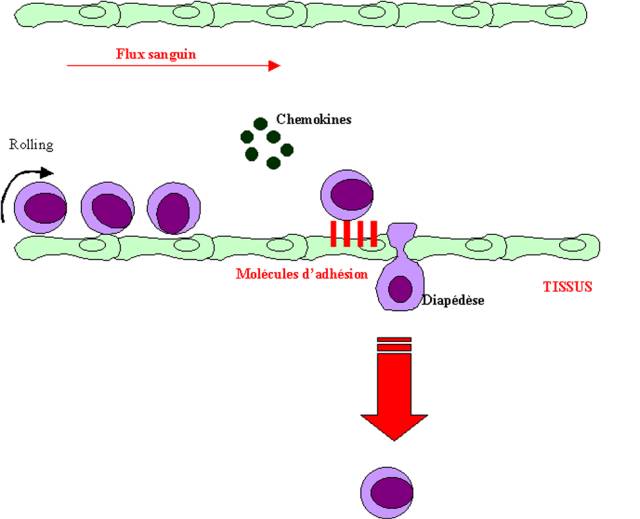
Le deuxième effet de ces médiateurs est d’induire l’expression des molécules d’adhésion à la surface des cellules endothéliales. Ces molécules permettent l’interaction entre l’endothelium et les phagocytes du sang circulant, et favorisent leur migration entre les cellules endothéliales vers les site de l’infection.
La première étape implique la fixation réversible des
leucocytes à l’endothélium vasculaire par des interactions entre les sélectines
de l'endothélium et leur ligand présent sur les leucocytes : l'antigène
sialyl-Lewisx. Cette interaction ne permet pas un ancrage stable du
leucocyte qui va simplement rouler à la surface de l’endothélium. La fixation
stable nécessite des interactions plus fortes qui mettent en jeu le couple ICAM-1
sur l’endothélium et son ligand LFA-1 sur le leucocyte. L’interaction de ces
deux molécules bloque le leucocyte et permet sa migration à travers
l’endothélium. La migration du leucocyte dans le tissu conjonctif dépend du
gradient de concentration en chimiokines sécrétées par les cellules
phagocytaires présentes au site de l’infection.
Figure 7 : Modification endothéliale et réponse inflammatoire.
B – 2 – Rôles du TNF-a
Le TNF-a produit par les phagocytes au cours de la réponse inflammatoire agit directement sur les cellules endothéliales. Le TNF-a augmente le flux sanguin, la perméabilité vasculaire aux fluides, aux protéines et aux cellules, et conduit à la fixation des leucocytes et des plaquettes à l’endothélium. Ce phénomène favorise la coagulation au niveau des petits vaisseaux en contact direct avec le site infectieux, ce qui évite la diffusion du pathogène et son passage dans la circulation. Le drainage du site inflammatoire vers le ganglion lymphatique loco-régional où la réponse immune adaptative pourra être déclenchée est aussi facilité.
Dans le cas d’une infection systémique, l’action du TNF
peut avoir des conséquences catastrophiques. Les septicémies s’accompagnent en
effet de la production de quantité élevées de TNF par les macrophages du foie
et de la rate. Il s’ensuit une vasodilatation et une augmentation de la
perméabilité membranaire entraînant un collapsus cardio-vasculaire. Dans le
choc septique, la production massive de TNF induit en outre une coagulation
intra-vasculaire disséminée avec consommation massive des facteurs de la
coagulation. Les capacités de coagulation étant perdues, le syndrome
hémorragique aboutit à des défaillances multi-viscérales et à la mort du
patient.
Figure 8 : Rôle du TNF-a.
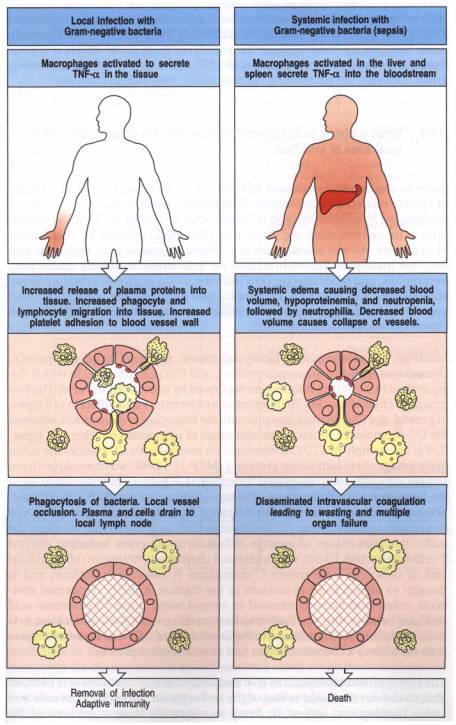
Photo :
Immunobiology, 1998, CA. Janeway, Ed Garland Publishing
B – 3 – Rôle des chimiokines
Les chimiokines sont des petits peptides apparentés aux cytokines synthétisés par les phagocytes. Toutes les chimiokines ont des structures peptidiques assez semblables. Ces molécules ont toutes la propriété d'être chimiotactiques pour les leucocytes. Elles permettent le recrutement des monocytes et des polynucléaires du sang vers le site de l’infection. Certaines chimiokines participent aussi au développement des lymphocytes et à l’angiogénèse. Ainsi, les phagocytes tissulaires amorcent la réponse immunitaire et leur nombre est rapidement augmenté par l’action des chimiokines qui recrutent de nombreuses cellules phagocytaires sur le site de l’infection.
B
– 4 – Rôle des polynucléaires neutrophiles
Les polynucléaires neutrophiles prédominent initialement dans l’infiltrat inflammatoire sur le lieu de l’infection. La réponse innée produit en effet de nombreux facteurs chimiotactiques pour les polynucléaires neutrophiles qui migrent rapidement du sang vers les tissus infectés. A ce niveau, les neutrophiles peuvent éliminer de nombreux pathogènes par phagocytose. Cette phagocytose peut être directe par l’intermédiaire de récepteurs spécifiques de structures présentes à la surface de la bactérie, ou indirecte après opsonisation par des anticorps et des protéines du complément. De plus, les neutrophiles produisent des métabolites toxiques de l’oxygène, du monoxyde d’azote, des protéases, des phospholipases, ainsi que des peptides antibactériens capables d’éliminer des bactéries GRAM+ ou GRAM-, des levures, voire certains virus enveloppés.
B – 5 – Protéines de la phase aiguë de l’inflammation
Les cytokines produites par les phagocytes ont aussi des effet systémiques qui contribuent à l’élimination des pathogènes. Parmi ceux-ci, on note l’augmentation de la température corporelle. La fièvre est généralement bénéfique puisque de nombreux micro-organismes se développent moins bien aux températures élevées.
Le second effet systémique des cytokines produites au cours de la réponse innée est l’induction d’ une leucocytose et notamment d’une polynucléose neutrophile. Les leucocytes ont deux origines : la moelle à partir de laquelle les leucocytes matures sont produits en grande quantité au cours des processus inflammatoires, et les vaisseaux sanguins où les leucocytes normalement attachés à l’endothélium sont décrochés et libérés dans la circulation sanguine (phénomène de " démargination ").
L’IL-1, l’IL-6 et le TNF-a activent la synthèse hépatocytaire des protéines de la phase aiguë de l’inflammation. Parmi ces protéines, deux sont particulièrement intéressantes car elles miment l’effet des anticorps sans, pourtant, en avoir la spécificité.
B
– 5 – 1 – La protéine C-réactive (CRP)
La CRP est une protéine de la famille des pentraxines. Elle se fixe sur les phosphorylcholines présentes à la surface de certaines bactéries. Lorsque la CRP est fixée à la bactérie, elle peut agir de deux façons. La première correspond à une opsonisation simple du micro-organisme favorisant ainsi sa phagocytose. Deuxièmement, la CRP peut activer la voie classique du complément en se fixant sur le composé C1q avec lequel elle a une certaine parenté structurale.
B
– 5 – 2 – La " mannose binding lectine " (MBL)
Cette protéine est présente en faible quantité dans le
sérum mais est produite massivement au cours de la réponse inflammatoire. Elle
se fixe sur des résidus " mannose " présents à la surface
de nombreuses bactéries. Comme la CRP, la MBL peut agir à la fois en opsonisant
le micro-organisme ou en activant le complément.
Figure 9 : Rôle des protéines de la phase aiguë de l’inflammation.
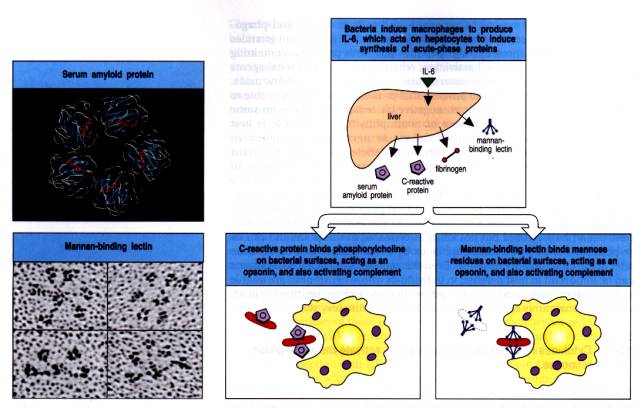
Photo :
Immunobiology, 1998, CA. Janeway, Ed Garland Publishing
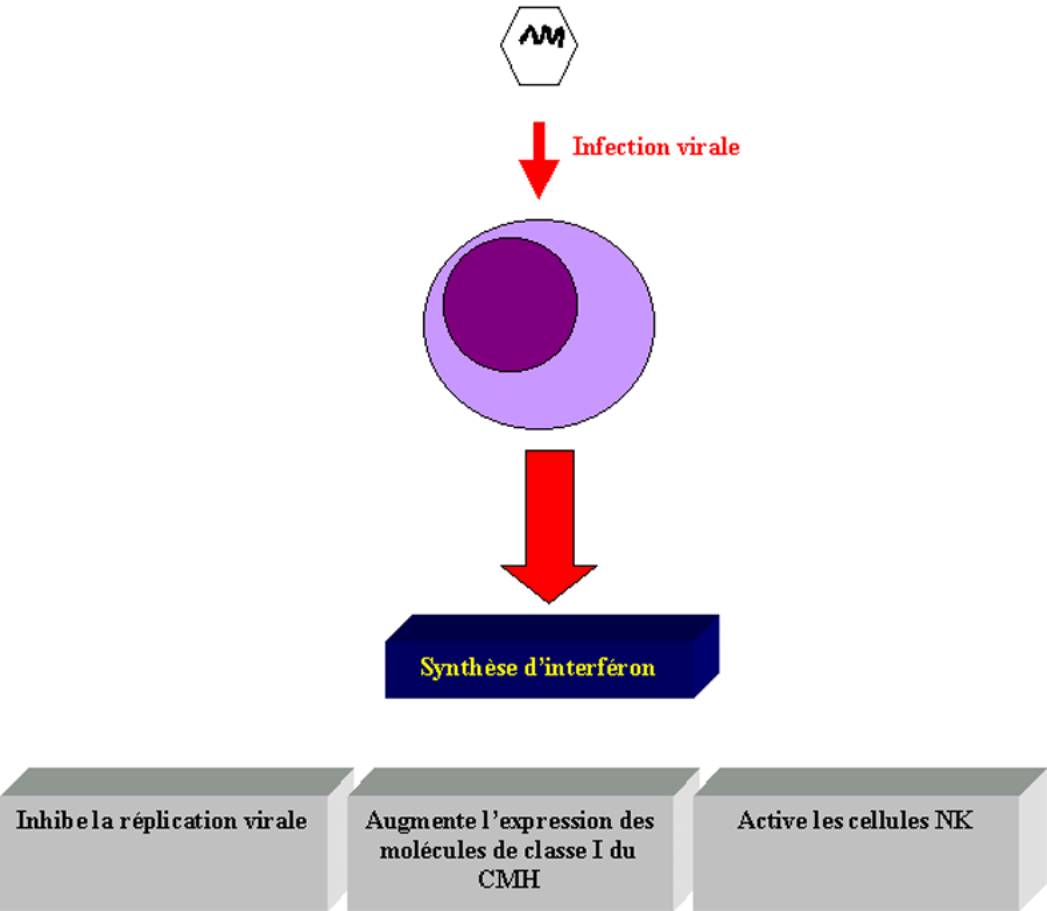
B – 6 – Rôle des interférons dans l’immunité antivirale
Le terme " interféron " désigne un groupe hétérogène de protéines à activité antivirale. Les IFN-a et-b sont produits par de nombreux types cellulaires en réponse aux infections virales, à l’ARN double brin et aux LPS. L’IFN-g diffère des autres interférons dans la mesure où c’est une lymphokine produite par les lymphocytes T activés. Il se combine à un récepteur différent decelui des IFN-a et –b.
Les effets anti-viraux des interférons s’exercent par divers mécanismes qui sont :
· Une augmentation d’expression des molécules de classe I et II du CMH
· L’activation des cellules NK et des macrophages
· L’inhibition directe de la réplication virale
Figure 10 : Rôle des interférons de type 1 dans l’immunité anti-infectieuse.
C – Cellules
impliquées dans l’immunité non adaptative
C
– 1 – Rôle des cellules NK
Les cellules NK jouent un rôle fondamental dans le contrôle précoce de certaines infections à germes intracellulaires (Herpes, Leishmania, Listeria). L’activité cytotoxique des cellules NK est considérablement augmentée par l’IFN-a et par l’IL-12 deux cytokines produites durant les phases initiales de la réponse immune non adaptative.
Le mécanisme par lequel la cellule NK reconnaît la cellule infectée implique deux types de récepteurs de surface.
Le premier est une lectine à activité activatrice capable de reconnaître de nombreuses molécules à la surface des cellules infectées et d’activer la cytotoxicité des cellules NK.
Le deuxième type de récepteur inhibe au contraire la cytotoxicité des cellules NK. Ces récepteurs inhibiteurs (KIR) reconnaissent les molécules de classe I du CMH à la surface de la cellule cible. Si la cellule exprime une quantité normale de molécules de classe I, le récepteur inhibiteur est activé et la cellule NK ne peut pas détruire sa cible. En revanche, si au cours d’une infection virale, le niveau des molécules de classe I du CMH est diminué, la cellule NK ne recevra plus de signaux inhibiteurs et pourra activer ses mécanismes effecteurs et détruire sa cible.
C – 2 – Rôle des cellules T gd
Les lymphocytes T gd représentent une minorité de cellules circulantes. Ils se localisent surtout dans les épithéliums de surface, par exemple la peau et les muqueuses, et sont appelés lymphocytes intra-épithéliaux. Les cellules T gd reconnaissent plus particulièrement des antigènes bactériens très conservés comme les protéines de choc thermique. La reconnaissance de l’antigène se fait directement sans présentation via une molécule de CMH.
C
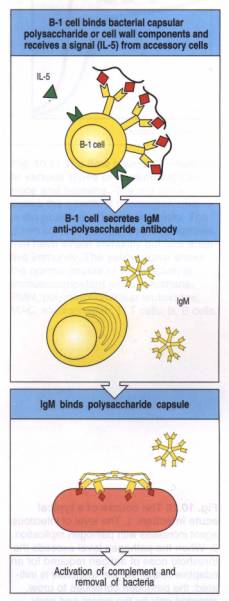
– 3 – Rôle des lymphocytes B1a
La production d’anticorps par les lymphocytes B conventionnels joue un rôle primordial dans la réponse immunitaire adaptative. Il existe cependant une lignée de lymphocyte B qui se distingue par l’expression du marqueur membranaire CD5. Ces lymphocytes sont appelés B1a et possèdent des propriétés différentes des lymphocytes B conventionnels. Les lymphocytes B1a produisent naturellement des anticorps d’isotype IgM dirigés contre des antigènes polysaccharidiques. La production de ces anticorps semble requérir la présence d’IL-5. Ils sont produits 48 heures après l’infection et peuvent se combiner avec les polysaccharides présents à la surface des bactéries. Une fois fixés à la surface bactérienne, ces anticorps peuvent activer très efficacement le complément.