![]()

Chapitre 9
SIGNAUX INTRACELLULAIRES
D’ACTIVATION DES LYMPHOCYTES B
I – Introduction
Après leur production par la moelle osseuse, les cellules B matures entrent dans un état quiescent et le demeurent jusqu'à ce qu’elles rencontrent un antigène. Le contact avec l’antigène et les Ig de membrane active le lymphocyte B. Cette activation se traduit par une augmentation de l’expression membranaire des molécules de classe II du CMH, l’entrée en cycle des cellules, et dans le cas d’une stimulation antigénique forte, par leur prolifération. Les lymphocytes B ne sont pas seulement des cellules effectrices capables de synthétiser des immunoglobulines, ils peuvent également apprêter et présenter des antigènes aux lymphocytes T spécifiques. Ainsi, après contact avec l’antigène, le complexe Ig de surface-antigène est internalisé, l’antigène est dégradé en petits fragments dans les endosomes et les lysosomes et les peptides dérivés de l’antigène exprimés à la surface du lymphocyte B en association avec les molécules de classe II du CMH. Le complexe CMH-peptide peut alors être reconnu par les lymphocytes T spécifiques. Ce type d’interaction entre le lymphocyte B et le lymphocyte T n’est pas le seul, En effet, le lymphocyte T exprime à sa surface des molécules capables d’interagir avec des protéines membranaires présentes sur le lymphocyte B. De plus, le lymphocyte T activé produit des facteur solubles qui peuvent influer sur la prolifération et la différenciation des lymphocytes B. Si les cytokines responsables de la stimulation et de la différenciation des cellules B sont assez bien connues, les molécules de surface capables d’activer les cellules B ont été caractérisées seulement récemment. Ainsi, l’identification de CD40 Ligand exprimé sur les cellules T activées a t-il permis de mieux appréhender le rôle des différentes molécules membranaires présentes sur le lymphocyte T et capables d’activer le lymphocyte B.
Bien que la production d’anticorps vis à vis de protéines antigéniques par le lymphocyte B requière la coopération des lymphocytes T auxiliaires, il existe des réponses anticorps qui se développent sans l’aide de ces cellules. Ces réponses T indépendantes sont classées en deux catégories. Les réponses de type I sont induites par des antigènes comme les lipopolyssacharides bactériens qui se comportent comme des activateurs polyclonaux des lymphocytes B. Les réponse de type II sont observées en réponse à des antigènes polyssacharidiques qui sont capables d’activer vigoureusement et durablement les Ig de surface des lymphocytes B. Quel que soit le type de réponse B thymo-indépendante, les cytokines semblent jouer un rôle primordial dans l’activation de la fonction sécrétoire d’anticorps des lymphocytes B ainsi activés. Cependant, bien que les cytokines impliquées dans la commutation isotypique en réponse à un antigène T-dépendant soient bien caractérisées, les signaux requis pour le commutation au cours de la réponse T indépendante ont été décrits seulement récemment.
II – Activation du lymphocyte B par les
Ig de surface
La transduction du signal par les Ig de surface est induite par la liaison avec des antigènes multi- ou oligomériques. Expérimentalement, cet événement est couramment induit par des anticorps anti-IgM. Il faut cependant garder à l’esprit que les vrais antigènes activent le BcR de façon un peu différente. Ces différences peuvent résulter des propriétés physiques de l’antigène, de sa capacité à interagir avec d’autres molécules présentes à la surface de la cellule B ou de l’affinité de l’interaction avec les Ig de surface.
Le BcR a une structure hétéro-oligomérique. C’est un complexe tétramérique composé de deux chaînes lourdes ancrées à la membrane et de deux chaînes légères. La région cytoplasmique des Ig de membrane est courte : 3 résidus pour les IgM et les IgD et 28 résidus pour les IgG. Cette région intracytoplasmique ne joue aucun rôle dans la transduction du signal induit par la fixation de l’antigène sur les Ig membranaires. Ce rôle est dévolu à des protéines étroitement associées au BcR : Iga et Igb (CD79a et b). Tout comme le CD3 présent sur les lymphocytes T, ces protéines possèdent des motifs ITAM qui vont permettre l’initiation de la cascade de phosphorylation observée après activation du récepteur des cellules B.
Ces réactions sont induites rapidement puisque 5 secondes après l’activation du BcR on voit apparaître une phosphorylation sur les tyrosines. Les segments intracytoplasmiques des Iga et b étant dépourvus d’activité enzymatique intrinsèque, il existe donc des protéines tyrosine kinases couplées à la face interne du complexe BcR-Ig a et b qui permettent la phosphorylation des ITAM. Cinq protéines tyrosine kinases sont impliquées dans ce processus. Quatre d’entre elles appartiennent à la famille Src : p53/56lyn, p55blk, p59fyn et p56lck. Ces protéines tyrosine kinases de la famille Src ont une structure particulière. Elles sont toutes myristylées en N-terminal. Elles se composent d’un domaine aminoterminal propre à chaque tyrosine kinase, d’un domaine SH3 qui permet l’association à des motifs riches en proline et d’1 domaine SH2 formé de deux poches présentant une sélectivité pour les tyrosines phosphorylées et pour l’acide aminé en +3 de la tyrosine phosphorylée. Le domaine SH2 des protéines de la famille Src a un rôle primordial dans la phosphorylation des ITAM puisqu’il permet la mise en contact directe entre l’enzyme et son substrat. Enfin, les protéines de la famille Src possèdent un site catalytique. Il existe dans la protéine deux sites permettant de réguler l’activité tyrosine kinase de l’enzyme. Le site à l’intérieur du domaine kinase augmente l’activité catalytique de l’enzyme et le site proche de l’extrémité C-terminale inhibe au contraire l’activité kinase de l’enzyme. Ce deuxième site est impliqué dans les interactions intramoléculaires avec le domaine SH2 rendant ainsi l’enzyme inactive. Dans cette conformation, le domaine SH3 interagit avec un site présent entre le domaine SH2 et le domaine catalytique de l’enzyme. L’ensemble de ces interactions intramoléculaires permettent à l’enzyme d’être dans une conformation ou l’activité kinase est réprimée. Outre les protéines de la famille Src, les protéines tyrosine kinases de la famille syk jouent un rôle dans le déclenchement et l’amplification du signal induit après ligation du BcR par l’antigène. Les protéines de la famille Syk sont : Zap-70 présent dans les lymphocytes T et Syk présent dans les lymphocytes B, les plaquettes et certaines populations de thymocytes. Ces protéines ne possèdent pas de domaine SH3 mais deux domaines SH2 en tandem. Après contact avec l’antigène, syk s’associe à la région intracytoplasmique des chaînes lourdes des Ig de surface et s’autophosphoryle. Les protéines de la famille Src p59fyn et p53lyn s’associent alors à p72Syk grâce à leur domaine SH2. La fixation des protéines de la famille Src à Syk modifie leurs conformations permettant la phosphorylation du site activateur présent sur le domaine catalytique. P59fyn et p53lyn ainsi activées vont alors pouvoir phosphoryler les ITAM des régions intracytoplasmiques des Iga et Igb. S’en suit une redistribution des protéines tyrosine kinases avec recrutement de p72syk aux ITAM phosphorylés et association d’autres strates de protéines impliquées dans la transduction du signal comme SHC, SOS, Grb2 qui vont activer la voie p21Ras.
III - Régulation de l’activation du
lymphocyte B
A - Rôle de
CD45.
Le CD45 est une protéine tyrosine phosphatase membranaire. Elle est exprimée dans toutes les cellules hématopoïétiques. CD45 a un rôle majeur dans la transduction des signaux activateurs après contact de la cellule immunocompétente avec l’antigène. Il existe une certaine dualité dans le rôle du CD45. En effet, l’activité phosphatase du CD45 peut induire la déphosphorylation des ITAM et ainsi avoir un effet inhibiteur sur l’activation lymphocytaire. Cependant, l’activité phosphatase du CD45 s’exerce principalement à l’égard des protéines tyrosine kinases p56lck et p59fyn. CD45 déphosphoryle préférentiellement ces protéines sur leur tyrosine C-terminale inhibitrice et participe donc activement à l’activation lymphocytaire.
Ce rôle activateur a d’ailleurs été clairement établi chez les souris invalidées pour le gène du CD45. Chez ces animaux, on observe des altérations touchant exclusivement les cellules du système immunitaire. Le répertoire T est très restreint chez ces animaux et on observe un blocage de la maturation thymique au stade double négative, il en résulte une lymphopénie et une anergie des lymphocytes T. Chez ces souris, les lymphocytes B ont un développement normal. Toutefois, ils sont incapables de répondre aux antigènes. Cette anergie fonctionnelle est liée à des perturbations dans la transmission des signaux d’activation. Ainsi, CD45 semble être prépondérant dans le lymphocyte B pour la génération d’un signal. La possibilité pour le CD45 d’envoyer des signaux antagonistes aux cellules immunocompétentes nécessite donc une régulation de son activité en fonction de l’état d’activation de la cellule. En fait, la possibilité pour le CD45 d’envoyer selon les cas des signaux divergents dépend de sa localisation. Dans les cellules au repos, les protéines de la famille Src sont continuellement régulées par deux enzymes : CD45 et Csk (C-terminal Src kinase) aux activitées opposées. Au repos, CD45 déphosphoryle les kinases sur leurs deux sites ce qui a pour effet de les rendre inactives. Après contact avec l’antigène, les protéines membranaires se relocalisent, les protéines kinases s’associent aux complexes formés par le récepteur de l’antigène. de façon concomitante, la composition lipidique de la membrane au contact du BcR se modifie pour former des structures appelées " radeau ". A l’intérieur de ces radeaux sont regroupés toutes les protéines nécessaires à l’activation de la cellule B. CD45 est exclu des radeaux, éloignant ainsi le CD45 du BcR empêchant ainsi la déphosphorylation des ITAM. Les Src kinases ayant été préalablement déphosphorylées par le CD45 sur leur tyrosine inhibitrice, leur tyrosine activatrice est libre et peut être transphosphorylée.
B - Rôle du
complexe CD19-CD21-CD81
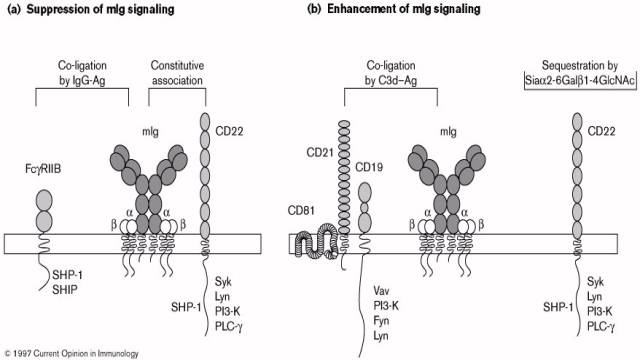
Le CD19 est une glycoprotéine appartenant à la superfamille des immunoglobulines. Sa région extracellulaire est composée de deux domaines C2 de type immunoglobuline. Parmi les protéines appartenant au complexe, seul CD19 possède une région intracytoplasmique composée de 240 acides aminés. CD19 est exprimé tout au long de la différenciation des lymphocytes B jusqu’au stade plasmocyte. La ligation des Ig de surface du lymphocyte B a pour conséquence la phosphorylation de résidus tyrosines présent dans la région intracytoplasmique du CD19. Ces tyrosines phosphorylées vont permettre le recrutement et la fixation de protéines tyrosine kinases comme fyn, lyn, vav et de la PI-3 kinase. La surexpression du CD19 chez la souris induit un blocage du développement médullaire des lymphocytes B au stade pré-B. Chez les souris invalidées pour le gène du CD19, on n’observe pas d’altération apparente du développement médullaire de lymphocytes B-2 conventionnels. En revanche, chez ces animaux, le nombre de lymphocytes B1-a péritonéaux est réduit suggérant un rôle du CD19 dans le développement et la persistance de ces cellules. En effet, l’injection d’anticorps anti-CD19 diminue le nombre de lymphocytes B1a en bloquant leur réplication. La réplication des lymphocytes B1-a nécessitant l’activation de leurs Ig de surface, CD19 pourrait jouer un rôle de costimulation de l’activation du lymphocyte B. Au niveau fonctionnel, les souris invalidées pour le CD19 montrent une diminution de leur réponse anticorps aux antigènes thymodépendants. Cette inhibition est associée à un défaut de formation des centres germinatifs et à une altération de la maturation de l’affinité des anticorps pour l’antigène. L’absence de CD19 ne semble cependant pas altérer la réponse B aux antigènes thymo-indépendants. Enfin, CD19 semble être impliqué dans le trafic des cellules B vers les aires riches en cellules T dans les ganglions lymphatiques renforçant ainsi l’implication du CD19 dans les interactions cellulaires T-B.
CD21 est une glycoprotéine de la famille des récepteurs du complément. On l’appelle CR2 pour complément récepteur de type 2. A ce titre, CD21 peut fixer C3bi, C3d, C3dg. CD21 est exprimé seulement sur les lymphocytes B matures. CD21 permet le pontage du BcR et du complexe CD19-CD21-CD81 par l’intermédiaire de l’antigène recouvert de C3. Le ligand de CD21 est généré durant l‘activation du complément et la fixation du C3d sur l’antigène. La fixation du C3d sur le CD21 permet le pontage du BcR et du complexe CD19-CD21-CD81. L’immunogénicité des antigènes modifiés par le composé C3d a été étudiée avec l’antigène HEL couplé à une, deux ou trois molécules de C3d. Ainsi, HEL-C3d1, HEL-C3d2 et HELC3d3 étaient respectivement 10-, 100-, et 1000 fois plus actifs que HEL seul pour activer in vitro les lymphocytes B spécifiques de cet antigène.
CD81 participe au complexe de costimulation CD19-CD21.
Cette protéine est exprimée à tous les stades de la maturation des lymphocytes
B et sur de nombreux autres type cellulaires. CD81 serait le corécepteur
permettant la pénétration du virus de l’hépatite C dans les hépatocytes.
Figure 1 : Rôle des corécepteurs dans l’activation du lymphocyte B.
C - Rôle du
CD22.
Le CD22 est une glycoprotéine de 135kD possédant deux motifs ITAM intracytoplasmiques. CD22 est exprimé dans les cellules pro et pré-B. Toutefois, son expression membranaire est corrélée à celle des IgD de surface. Lors de l’engagement du BcR, les ITAM de CD22 sont phosphorylés par les Iga et b. Syk peut alors s’associer aux ITAM phosphorylés par ses domaines SH2. CD22 peut aussi fixer la phosphotyrosine phosphatase SHP1. Cette protéine cytoplasmique est indispensable au contrôle négatif du signal médié par le BcR. A l’état basal, SHP1 est fixé aux Iga et b et s’en dissocie après contact avec l’antigène. Quand le BcR est assez phosphorylé, SHP1 revient se fixer au BcR pour arrêter le signal. Le rôle de SHP1 comme contrôle négatif de l’activation lymphocytaire a bénéficié de la découverte d’une mutation dans le gène codant pour SHP1 chez les souris motheaten. Ces animaux développent de nombreux stigmates biologiques d’autoimmunité : Ac anti ADN, facteur rhumatoïde et la présence exclusive de lymphocytes B1a.
D - Rôle des
RFcgIIb
La coligation RFcgIIb et BcR supprime les signaux induits
par le BcR. Un tel effet est observé lorsque l’antigène forme des immuns
complexes avec des IgG. Ainsi, le produit de la réponse immune que sont les
anticorps spécifiques de l’antigène peuvent, via ce récepteur, réguler négativement
l’activation des lymphocytes B qui les sécrètent. Le rôle du RFcgIIb dans le
contrôle des taux sériques d’un anticorps spécifique a été observé in vivo chez
les souris invalidées pour ce gène. RFcgIIb exerce son effet en bloquant les
flux calciques générés au cours de l’activation lymphocytaire. Cet effet dépend
de la phosphorylation d’une tyrosine contenue dans un motif particulier :
YSLL appelé ITIM. Lors de la coligation du BcR et de RFcgIIb ce motif est
phosphorylé et interagit alors avec la protéine SHP1.
Figure 2 : Signaux d’activation du lymphocyte B.
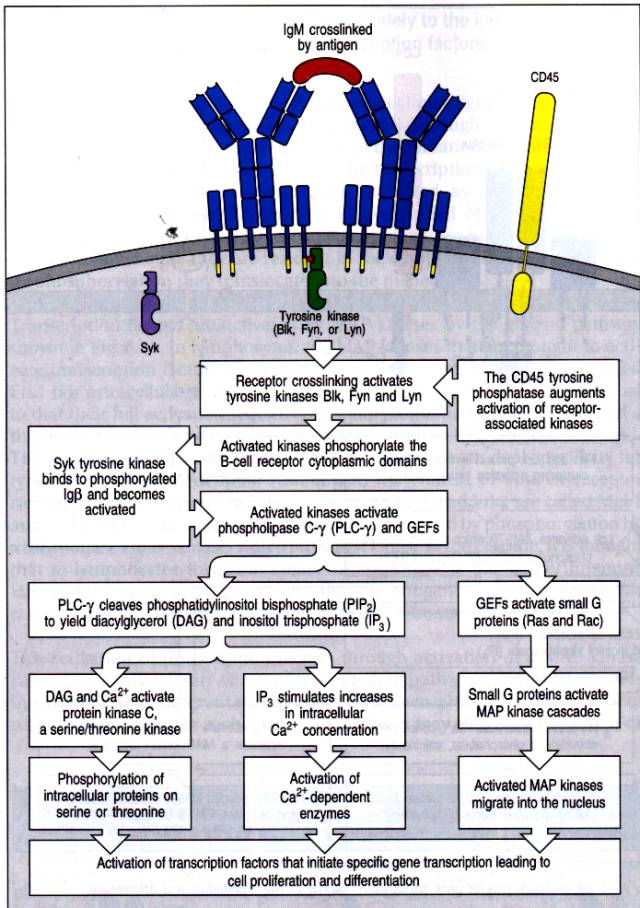
Photo :
Immunobiology, 1998, CA. Janeway. Ed Garland Publishing